ЛАБОРАТОРНА РОБОТА №6.
ВИЗНАЧЕННЯ ЗАГАЛЬНОЇ КАЛЬЦІЄВОЇ ТА МАГНІЄВОЇ ТВЕРДОСТІ ВОДИ КОМПЛЕКСОНОМЕТРИЧНИМ МЕТОДОМ
Теоретичний вступ
Катіони Са2+ та Mg2+ і важких металів зумовлюють твердість води. Але в зв’язку з тим, що в природних водах переважають йони Са2+ та Mg2+, то загальна твердість води може бути охарактеризована сумою концентрацій йонів Са2+ та Mg2+.
В нашій країні твердість виражають сумою ммоль-екв йонів Са2+ та Mg2+, які містяться в одному літрі води. Один ммоль-екв відповідає вмісту у воді 20,04 мг/л. Са2+ або 12,15 мг/л Mg2+.
За величиною загальної твердості природні води за О.Альокіним поділяють на такі групи:
1) дуже м’які води (<1,5 ммоль-екв/л);
2) м'які води (1,5-3,0 ммоль-екв/л);
3) води середньої твердості (3,0- 5,4 ммоль-екв/л);
4) тверді води (5,4-10,7 ммоль-екв/л);
5) дуже тверді води (>10,7 ммоль-екв/л).
Існують ще інші класифікації води за твердістю.
Найбільш м’які води – це води атмосферних опадів, які мають твердість 70-100 мкмоль-екв/л. Твердість підземних вод визначається складом контактуючих з ними порід. Так, грунтові води Донбасу, які формуються під дією крейдяних та доломітових порід, є дуже твердими (~18-30 ммоль-екв/л).
Твердість річкових вод залежить від кліматичних умов і характеру живлення річок, а також від пори року. Наприклад, твердість води (ммоль-екв/л) в таких річках складає:
Дніпро - 5,135
Дон - 5,777
Амур - 1,448
Волга (нижня течія) - 6,490.
Твердість води в морях значно вища. Так, вода Чорного моря має загальну твердість 65,5 ммоль-екв/л. Середнє значення твердості води світового океану 130,5 ммоль-екв/л. Загальна твердість питної води за ДСанПіН України може бути не більша за 7 ммоль-екв/л (додаток, табл.1).
У воді йони Са2+ та Mg2+ можуть бути зв’язані з різними аніонами (НСО3-, СО32-, SO42-, С1- тощо).
Таку твердість води, яка обумовлена наявністю гідрогенкарбонатів кальцію і магнію, називають карбонатною, а твердість води, яка обумовлена наявністю сульфатів, хлоридів та інших солей Са2+ та Mg2+, називають некарбонатною. При тривалому кип'ятінні води з карбонатною твердістю в ній з’являється осад:
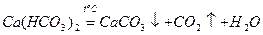 ;
;
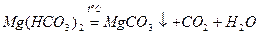 ;
;
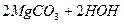 L
L 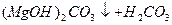 ;
;
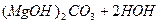 L
L 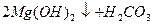 .
.
Твердість води, яка усувається при її кип’ятінні, називають тимчасовою твердістю. Треба розрізняти карбонатну і тимчасову твердість. При кип’ятінні у воді залишається деяка кількість йонів Са2+, Mg2+, СО32-. Різниця між карбонатною і тимчасовою твердістю характеризує залишкову твердість. Твердість води, яка залишається після її кип'ятіння, називається постійною.
Присутність у воді значної кількості солей Са2+ та Mg2+ спричиняє непридатність води для господарсько-побутових потреб та інших видів водокористування.
Для водозм’якшення застосовують методи осадження та йонного обміну. Метод осадження поділяється на термічний та реагентний. При застосуванні термічного методу воду кип’ятять. При цьому відбуваються такі процеси:

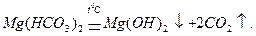
При застосуванні реагентного методу у воду вводять різні реагенти. Найчастіше це вапно і сода, а також розчинні фосфати.
Вапнування води:
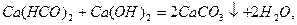
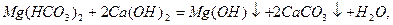
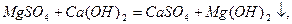

При застосуванні соди Na2CO3 відбуваються такі реакції:


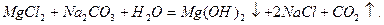
Для усунення твердості методом йонного обміну воду пропускають через катіоніти. При цьому катіони Са2+, Mg2+, які знаходяться у воді, обмінюються на катіони Na+ або Н+, які містяться в катіоніті:
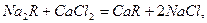

(Н2R застосовують, якщо  ммоль-екв/л).
ммоль-екв/л).
Комплексонометричний метод визначення загальної твердості води заснований на зв’язуванні йонів Кальцію та Магнію натрій етилендиамінтетраацетом натрію (ЕДТА) – трилоном Б в комплексні сполуки.
Формула трилону Б:

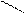 NaOOC – H2C CH2 - COONa
NaOOC – H2C CH2 - COONa

 N – CH2 – CH2 – N . 2H2O
N – CH2 – CH2 – N . 2H2O
HOOC – H2C CH2 – COOH
При наявності у воді йонів Са2+ і Mg2+ відбувається така реакція:
Ме2+ + Н2ЕДТА2- = МеЕДТА2- + 2Н+,
де: Ме - Са2+ або Mg2+.
Стійкі комплексні сполуки утворюються при рН=10. Для підтримування такого значення рН застосовують буферну суміш - амоній гідроксиду з амоній хлоридом.
При додаванні індикатора еріохрому чорного Т розчин набуває вишнево-червоного забарвлення: утворюються комплекси зазначеного індикатора з йонами Са2+ і Mg2+. Коли йони Кальцію та Магнію повністю відтитруються, індикатор витісняється з сполук, а у вільній формі він має синє забарвлення. Поява синього забарвлення означає кінець титрування.
Незалежно від заряду катіонів 1 моль катіонів зв’язується з 1 моль ЕДТА: fЕКВ (Меn+) = fЕКВ (ЕДТА) = 1; Ме(Меn+) = М(Меn+), Ме(ЕДТА) = М(ЕДТА); Сн. (ЕДТА) = См(ЕДТА).
Дата добавления: 2016-05-16; просмотров: 1214;
