Експериментальна частина. 1. Визначення загальної твердості води
1. Визначення загальної твердості води
До 100 мл досліджуваної води, відміряної мірною колбою в конічну колбу на 250 мл, додають 5 мл амоніачного буферного розчину (NH4OH+NH4Cl)* та 6-7 крапель розчину індикатора еріохрому чорного Т.
Цей розчин повільно титрують 0,05н. розчином трилону Б до зміни забарвлення на синє. Це свідчить про те, що всі йони Са2+ та Mg2+ зв’язані трилоном Б.
Загальну твердість води визначають за формулою
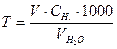 (ммоль-екв/л),
(ммоль-екв/л),
де V – об’єм розчину трилону Б, який витрачений на титрування досліджуваної води, мл; Сн. – молярна концентрація еквівалента (нормальна концентрація) розчину трилону Б; 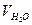 - об’єм досліджуваної води, мл.
- об’єм досліджуваної води, мл.
Результати трьох дослідів внести в таблицю:
| № з.п. |  , мл , мл
| VТБ, мл | Сн.ТБ | 
|
| Сер. |
* Приготування амоніачного буферного розчину. До 2 г амоній хлориду додають 100 мл 20%-ного розчину амоніаку і доводять об’єм розчину до 1 л.
Визначення кальцієвої та магнієвої твердості
Після визначення загальної твердості комплексонометричним методом осаджують йони Кальцію у вигляді кальцій оксалату СаС2О4:
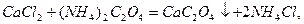
а згодом у фільтраті визначають магнієву твердість. Кальцієву твердість визначають, як різницю між загальною і магнієвою твердістю.
Хід визначення
До 100 мл досліджуваної води, відміряної мірною колбою в конічну колбу ємністю 250 мл, додають 1 мл спеціального буферного розчину* і 10-15 мл 5%-ного розчину амоній оксалату. При цьому випадає осад кальцій оксалату СаС2О4, який відфільтровують через щільний фільтр. Осад на фільтрі промивають 2 рази невеликою кількістю холодної дистильованої води. Промивні води приєднують до фільтрату і визначають твердість: до розчину додають 5 мл амоніачного буферного розчину, 6-7 крапель розчину індикатора еріохрому чорного Т і титрують 0,05н. розчином трилону Б.
Магнієву твердість розраховують за формулою
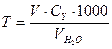 (ммоль-екв/л),
(ммоль-екв/л),
де V – об’єм розчину трилону Б, який витрачений на титрування, мл; 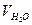 - об’єм досліджуваної води; СН – молярна концентрація еквівалента ( нормальна концентрація) трилону Б.
- об’єм досліджуваної води; СН – молярна концентрація еквівалента ( нормальна концентрація) трилону Б.
Кальцієву твердість обчислюють за формулою
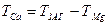 .
.
Вміст йонів Са2+ і Mg2+ знаходять за формулами
 , мг/л ;
, мг/л ; 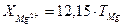 , мг/л.
, мг/л.
Результати визначення загальної, кальцієвої та магнієвої твердості записують у вигляді таблиці:
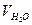
| 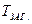 ,
ммоль-екв/л ,
ммоль-екв/л
| 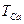 ,
ммоль-екв/л ,
ммоль-екв/л
| 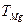 ,
ммоль-екв/л ,
ммоль-екв/л
| Вміст йонів Са2+, мг/л | Вміст йонів Mg2+, мг/л |
* Приготування спеціального буферного розчину.
До 67,5 г амоній хлориду додають 570 мл 25%-ного амоніаку і доводять дистильованою водою до 1 л.
Запитання для самоконтролю
1. Наявність яких сполук зумовлює твердість природних вод?
2. В яких одиницях виражають твердість води?
3. Як класифікують води за твердістю?
4. Які сполуки зумовлюють карбонатну твердість води?
5. Які є методи усунення карбонатної твердості?
6. Які сполуки зумовлюють постійну твердість води?
7. Які є методи усунення постійної твердості води?
8. В чому сутність методу осадження?
9. В чому сутність методу йонного обімну?
10. Чому необхідно проводити водозм’якшення?
Дата добавления: 2016-05-16; просмотров: 1062;
