ЛАБОРАТОРНА РОБОТА №8.
ВИЗНАЧЕННЯ ЙОНІВ ХЛОРУ У ВОДІ
Теоретичний вступ
В гідрогенкарбонатних водах переважають йони НСО3- і Са2+, у хлоридних – С1- і Na+. Йони Mg2+ займають проміжне положення між Na+ та Са2+, як і йони SO42- - між йонами НСО3- та С1-.
Зміна складу води відповідно до величини загальної мінералізації пояснюється різницею розчинності хлоридів, сульфатів та карбонатів лужних і лужноземельних металів. Мала розчинність карбонатних солей кальцію обмежує концентрацію гідрогенкарбонатних та карбонатних йонів в межах до 1000 мг/л. Порівняно невелика розчинність кальцій сульфату також обмежує вміст сульфатних йонів. Тільки хлоридні йони можуть досягати найбільших концентрацій внаслідок великої розчинності солей хлоридної кислоти.
Однією з найважливіших закономірностей складу природних вод є зміна концентрацій переважаючих йонів за схемою
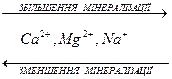
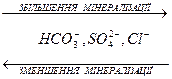
В прісних водах на гідрогенкарбонати припадає близько 60% загальної кількості солей, а на хлориди – менше 10%; в морській воді на хлориди припадає близько 80%.
Хлоридні йони присутні майже в усіх природних водах. Йони С1- не засвоюються рослинами та бактеріями, а виділяються у вільному стані організмами тварин.
В солоних озерах, а також в розсолах підземних вод вміст хлорид них йонів може досягати сотень г/кг.
Вміст хлоридів у питній воді не повинен перевищувати 250 мг/л (СанПіН України, додаток, табл.1), а в рибогосподарських водоймах – 300 мг/л (додаток, табл.4). Велика кількість хлоридів надає воді гірко-солоного смаку.
Визначення йонів С1- засноване на утворенні важкорозчинного аргентум хлориду при титруванні розчинів, які містять йони С1-, розчином аргентум нітрату. Як індикатор використовують калій хромат К2CrО4.
Після досягнення точки еквівалентності в реакції між йонами Хлору та йонами Аргентуму надлишок йонів Аргентуму утворює з К2CrО4 буро-червоний осад Ag2CrО4. Тому кінець реакції зв’язування хлорид-йонів в малорозчинний аргентум хлорид визначається за появою буро-червоного забарвлення розчину.
Дата добавления: 2016-05-16; просмотров: 567;
