Експериментальна частина. В колбу ємністю 100 мл наливають 50 мл досліджуваної води, 1 мл 50%-ного розчину сегнетової солі, 1 мл реактиву Несслера і перемішують
В колбу ємністю 100 мл наливають 50 мл досліджуваної води, 1 мл 50%-ного розчину сегнетової солі, 1 мл реактиву Несслера і перемішують. Через 10 хвилин розчин фотоколориметрують: визначають оптичну густину D в кюветі (l=30 мм) при синьому світлофільтрі №4. Після цього фотоколориметрують два стандартних розчини NH4Cl з концентрацією Нітрогену амоніаку 0,1 мг/л і 0,2 мг/л, до яких додають ті ж самі реактиви. Визначають оптичну густину D1cт. і D2ст.).
Вміст Нітрогену амоніаку СХ розраховують для кожного з стандартних розчинів за формулою
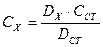 (мг/л).
(мг/л).
Потім знаходять середнє значення.
Результати дослідів подати у табличній формі за зразком:
| Досліджуваний об’єкт | VCT.РОЗЧИНУ, мг | m(V), мг | C(N), мг/л | D |
| Стандартний розчин 1 | ||||
| Стандартний розчин 2 | ||||
| Досліджувана вода | DX 1 DX 2 DСЕР. |
Запитання для самоконтролю
1. В чому полягає сутність фотоколориметричного методу визначення Нітрогену амоніаку?
2. Який закон лежить в основі цього методу? Як він формулюється?
ЛАБОРАТОРНА РОБОТА №12.
ВИЗНАЧЕННЯ НІТРОГЕНУ НІТРИТІВ
Теоретичний вступ
Нітрити – це солі нітритної кислоти HNO2. Їх визначення проводять за допомогою реактиву Грисса (суміш розчинів сульфанілової кислоти (1) та α-нафтиламіну(2) в розбавленій ацетатній кислоті. 0,5 г сульфанілової кислоти і 0,25 г α-нафтиламіну окремо розчиняють при нагріванні в 150 мл 12%-ного розчину ацетатної кислоти. Ці речовини у відсутності нітриту між собою не реагують. У присутності нітриту вони утворюють барвник рожевого кольору. Кількісне визначення Нітрогену нітритів можна проводити при його вмісті до 0,8 мг/л. При більшому вмісті досліджувану воду необхідно розбавляти.
NH2
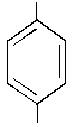 SO3H
SO3H
| NH2
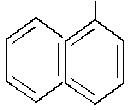
|
1 2
NH2
 SO3H
SO3H
|
 HNO2
HCl HNO2
HCl
| N=N-Cl
 SO3H
SO3H
|
Диазосполука
NH2
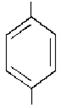 SO3H
SO3H
| + | NH2
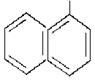
| 
| N = N – N – H |
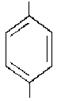 SO3H
Барвник
SO3H
Барвник
| 
|
Реакція відбувається в дві стадії. Спочатку утворюється диазосполука при дії на сульфанілову кислоту нітриту, який в ацетатнокислому середовищі переходить в нітритну кислоту.
Ця диазосполука реагує з α-нафтиламіном і утворюється барвник.
Гранично допустима концентрація в рибогосподарських водоймах N-NO2 (мг/л) – 0,02, а в питній воді за СанПіН України – нітрити відсутні (додаток, табл.4, 1).
Дата добавления: 2016-05-16; просмотров: 797;
