Дослід 3.2.1. Приготування приблизно 0,1 н розчину хлоридної кислоти
Перед початком роботи необхідно встановити концентрації вихідного розчину кислоти за допомогою ареометра. Ареометр (рис. 3.1) являє
| собою скляний поплавець з кулькою, заповненою дробом. У верхній вузькій частині ареометра є шкала з поділками, відповідними різним значенням густини. Поділка шкали ареометра, до якої він занурився у розчин, показує густину розчину (відлік фіксують за нижнім краєм меніску). Густину розчину визначають наступним чином. У мірний циліндр наливають розчин, опускають туди ареометр так, що б він вільно плавав у розчині не торкаючись дна і стінок циліндра. За шкалою арео- | 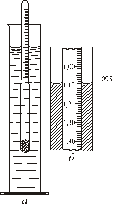
|
| Рис. 3.1. Ареометр (а) і відлік за його шкалою (б) |
метра відзначають його показання. Піднявши ареометр на 1-2 см, його знову занурюють у розчин і ще раз роблять відлік.
Для ряду речовин, наприклад, для кислот, лугів, солей є спеціальні таблиці (Додаток 1), користуючись якими, можна за густиною розрахувати масову частку розчиненої речовини. Якщо в таблиці густин немає значення, яке точно відповідає за шкалою ареометра, тоді масову частку знаходять методом інтерполяції (визначають проміжне значення за двома найбільш близькими значеннями у таблиці). Наприклад, за даними ареометра густина розчину хлоридної кислоти дорівнює 1,177. У таблиці наведені дані лише для розчинів з густинами 1,163 і 1,183, яким відповідають масові частки 32 і 36 %. У вузькому інтервалі залежність густин від концентраціі можна вважати лінійної і масову частку визначити наступним чином.
1) Знайти різницю густин і масових часток за даними таблиці:
| 1,183 | – 36 % | ||
| – | |||
| 1,163 | – 32 % | ||
| 0,020 | – 4 % |
2) Знайти різницю між густиною, визначеною за ареометром, і меншим значенням в таблиці (1,177-1,163 = 0,014) і скласти пропорцію.
| 0,020 | – 4 % | ||
| 0,014 | – х % |
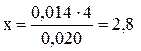 %
%
3) Додати отримане число до меншого значення масової частки, взятому з таблиці: 32 + 2,8 = 34,8 %. Ця величина відповідає масовій частці HCl у розчині хлоридної кислоти з густиною 1,177.
Встановивши густину і масову частку HCl у вихідному розчині кислоти, у викладача отримують конкретне завдання (обсяг і концентрацію розчину, який треба приготувати). Потім розраховують об’єм вихідної кислоти, необхідний для приготування заданого об’єму кислоти вказаної концентрації.
Після цього мірну колбу заповнюють приблизно наполовину дистильованою водою. Відміряють циліндром розрахований обсяг вихідної кислоти і виливають у мірну колбу. Колбу доливають водою до мітки, закривають і перемішують розчин.
Для визначення похибки досліду, знаходять концентрацію приготов-леного розчину. Для цього приготовлений розчин виливають у циліндр, вимірюють його густину ареометром і знаходять у таблиці значення масової частки хлоридної кислоти, відповідне цій густині розчину.
На підставі наявних даних розраховують нормальну концентрацію HCl отриманого розчину і порівнють із зазначеною в завданні. Обчислюють похибку досліду.
ГІДРОЛІЗ СОЛЕЙ. ВОДНЕВИЙ ПОКАЗНИК
Гідроліз солі – хімічна взаємодія іонів розчинної солі з водою з утворенням слабкого електроліту. Це призводить до накопичення іонів Н+ або ОН–і, відповідно, до зміни реакції середовища розчину солі. Гідролізу підлягають солі, утворені за участю слабких кислот або слабких основ. Солі, які є похідними сильних кислот і сильних основ, не гідролізують, оскільки їхні іони не зв’язують іони води (Н+ або ОН–) в слабкий електроліт, а отже, не зміщують її іонну рівновагу. Солі, до складу яких входять багатозарядні іони, гідролізують ступінчасто (за стадіями). При цьому гідроліз солі переважно відбувається за першим ступенем.
Розрізняють три основних типи гідролізу солей:
1. За катіоном – він характерний для солей, утворених катіоном слабкої основи і аніоном сильної кислоти. Наприклад:
Al2(SO4)3 + 2HOH 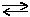 2AlOHSO4 + H2SO4 (I);
2AlOHSO4 + H2SO4 (I);
2Al3+ + 3SO  + 2HOH
+ 2HOH 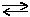 2AlOH2+ + 2SO
2AlOH2+ + 2SO 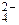 + 2H+ + SO
+ 2H+ + SO 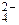 ;
;
2Al3+ + 2HOH 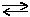 2AlOH2+ + 2H+;
2AlOH2+ + 2H+;
Al3+ + HOH 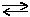 AlOH2+ + H+, рН < 7.
AlOH2+ + H+, рН < 7.
2AlOHSO4 + 2HOH 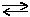 [Al(OH)2]2SO4 + H2SO4 (II);
[Al(OH)2]2SO4 + H2SO4 (II);
2AlOH2+ + 2SO 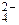 + 2HOH
+ 2HOH 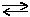 2[Al(OH)2]+ + SO4 + 2H+ + SO
2[Al(OH)2]+ + SO4 + 2H+ + SO 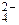 ;
;
2AlOH2+ + 2HOH 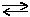 2[Al(OH)2]+ + 2H+;
2[Al(OH)2]+ + 2H+;
AlOH2+ + HOH 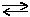 [Al(OH)2]+ + H+, рН < 7.
[Al(OH)2]+ + H+, рН < 7.
Третій ступінь гідролізу Al2(SO4)3 практично не відбувається. Внаслідок накопичення іонів H+ процес зміщується в бік вихідних сполук.
2.За аніоном –він характерний для солей, утворених катіоном сильної основи і аніоном слабкої кислоти. Наприклад:
Na3PO4 + НОН 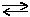 Na2НPO4 + NaОН (перший ступінь);
Na2НPO4 + NaОН (перший ступінь);
3Na+ + PO 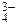 + НОН
+ НОН 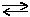 2Na+ + НPO
2Na+ + НPO 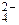 + Na+ + ОН–;
+ Na+ + ОН–;
PO 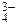 + НОН
+ НОН 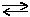 НPO
НPO 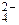 + ОН–, рН > 7.
+ ОН–, рН > 7.
Na2НPO4 + НОН 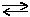 NaН2PO4 + NaОН;
NaН2PO4 + NaОН;
2Na+ + НPO 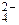 + НОН
+ НОН 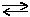 Na+ + Н2PO
Na+ + Н2PO 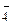 + Na+ + ОН–;
+ Na+ + ОН–;
НPO 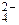 + НОН
+ НОН 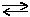 Н2PO
Н2PO 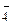 + ОН–, рН > 7.
+ ОН–, рН > 7.
Третій ступінь гідролізу з утворенням ортофосфатної кислоти Н3PO4 практично не відбувається.
3.Гідроліз солі за катіоном і аніоном –він характерний для солей, утворених катіоном слабкої основи і аніоном слабкої кислоти. Наприклад:
NH4СN + HOH 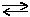 NH4OH + HCN;
NH4OH + HCN;
NH4+ + CN- + HOH 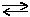 NH4OH + HCN.
NH4OH + HCN.
Скорочене іонне рівняння в цьому випадку не записують.
Гідроліз солей, утворених багатозарядними катіоном або аніоном, відбувається ступінчасто (переважно за першим ступенем).
Багато солей цього типу гідролізують необоротно. Прикладом солей, які зазнають повногогідролізу, є солі слабких основ і дуже слабких, нестій-ких або летких кислот: Cr2S3, Al2S3, Fe2(CO3)3, Al2(CO3)3, CuSiO3, Ag2SiO3, Fe2(SO3)3, SnCO3, інші. Їх гідроліз супроводжується повним розкладанням солі з виділенням вільних кислот і гідроксидів.
Рівняння реакцій повного гідролізу солей записують лише у молекулярному вигляді:
Al2S3 + 6HOH ® 2Al(OH)3¯ + 3H2S.
Через повний гідроліз ці солі не можуть бути одержані з водних розчинів.
Реакцію середовища розчинів характеризують за допомогою величини водневого показника рН.
Водневий показник рН – це негативний десятковий логарифм концентрації іонів Гідрогену в розчині.
рН = – lg[H+]
Якщо рН = 7 – середовище нейтральне; рН < 7 – кисле; рН > 7 – лужне.
ОКИСНО-ВІДНОВНІ РЕАКЦІЇ
Ступінь окиснення – умовний заряд атома, розрахований із припущення що молекула складається лише із іонів.
Для знаходження ступенів окиснення елементів у складних сполуках користуються наступними правилами:
1. Ступінь окиснення атомів в простих речовинах дорівнює нулю ( 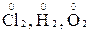 );
);
2. Атоми Оксигену в сполуках мають ступінь окиснення -2; виняток становлять пероксиди, де ступінь окиснення Оксигену складає -1 (наприклад,  ) і оксиген фторид
) і оксиген фторид 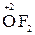 , де ступінь окиснення становить +2.
, де ступінь окиснення становить +2.
3. У Гідрогену в сполуках ступінь окиснення +1; виняток становлять гідриди металів, де ступінь окиснення Гідрогену складає -1 (наприклад, 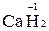 ).
).
4. Оскільки молекула у цілому електронейтральна, алгебраїчна сума ступенів окиснення усіх атомів, що входять у сполуку, дорівнює нулю.
У будь-якій окисно-відновній реакції беруть участь одночасно окисник і відновник. До відновників належать речовини, атоми (або іони) яких від-дають електрони, а до окиcників – речовини, що приєднують ці електрони. Процес віддавання електронів називається окисненням, а процес при- дбання електронів – відновленням.
Хімічні реакції, що протікають зі зміною ступенів окиснення елементів, що входять до складу речовин, називаються окисно-відновними.
Існує три типи окисно-відновних реакцій:
1. Реакції міжатомного або міжмолекулярного окиснення-віднов-лення. До них належать такі реакції, в яких обмін електронами відбува-ється між різними атомами, молекулами або іонами. Наприклад:
 .
.
Дата добавления: 2016-11-22; просмотров: 1319;
