Xiмiчнi властивості
Xiмiчнi властивості
Основі оксиди взаємодіють:
– з водою
СаО + Н2О → Са(ОН)2
– з кислотами
СаО + H2SO4 → CaSO4 + H2O
– з кислотними оксидами
ВаО + СО2 → ВаСО3
– з амфотерними оксидами
СаО + ZnO → CaZnO2.
Кислотними називають оксиди, які утворюють солі під час взаємодії з основами або основними оксидами i не взаємодіють з кислотами або кислотними оксидами.
Кислотним оксидам відповідають кислоти. Наприклад:
СО2 – Н2СО3
Р2О5 – Н3РО4
Xiмiчнi властивості
Кислотні оксиди взаємодіють:
– з водою
СО2 + Н2О → Н2СО3
– з основами
SО3 + 2NaOH → Na2SO4 + Н2О
– з основними оксидами
СО2 + СаО → СаСО3
– з амфотерними оксидами
Р2О5 + Аl2О3 → 2АlРО4
Амфотерними називають оксиди металів, які утворюють солі під час взаємодії як з кислотами або кислотними оксидами, так i з основами чи основними оксидами.
Xiмiчнi властивості
Амфотерні оксиди взаємодіють:
– з кислотами (та кислотними оксидами)
ZnO + 2НС1 → ZnCl2 + Н2О
– з основами (та основними оксидами)
ZnO + 2NaOH → Na2ZnО2 + Н2О.
Номенклатура оксидів
| Загальна формула i валентність елемента | Назва оксиду |
| Е2О; N2О | Нітроген (I) оксид |
| ЕО;СО | Карбон (II) оксид |
| Е2О3; Fe2O3 | Ферум (III) оксид |
| ЕО2;СО2 | Карбон (IV) оксид |
| Е2О5; Р2О5 | Фосфор (V) оксид |
| ЕО3; SO3 | Сульфур (VI) оксид |
| Е2О7; С12О7 | Хлор (VII) оксид |
| ЕО4; OsO4 | Осмій (VIII) оксид |
Основи
Основаминазивають сполуки, до складу яких входять катіони металу та гідроксильні групи. Інша назва основ – гідроксиди. Розчинні у воді основи називають лугами.
Xiмiчнi властивості
Основи взаємодіють:
– з кислотами (реакція нейтралізації)
NaOH + НСl → NaCl + Н2О
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
– з кислотними оксидами
2NaOH + СО2 → Na2CO3 + Н2О
Са(ОН)2 + СО2 → СаСО3 + Н2О
– з розчинами середніх i кислих солей (тільки луги)
2КОН + CuCl2 → Cu(OH)2↓ + 2KC1
NaOH + NaHCO3 → Na2CO3 + Н2О
– основи розкладаються під час нагрівання
Cu(OH)2 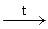 CuO + Н2О
CuO + Н2О
2Fe(OH)3 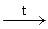 Fe2O3 + ЗН2О
Fe2O3 + ЗН2О
Амфотерні гідроксиди
Амфотерні гідроксиди одночасно можна розглядати i як кислоти, i як основи, тобто такі сполуки, в яких Гідроген може заміщуватись на атоми металу, а гідроксильна група – на кислотний залишок. Наприклад:
Zn(OH)2, А1(ОН)3, Cr(OH)3, Sn(OH)4, Pb(OH)2тощо
Амфотерні гідроксиди з кислотами реагують як основи, а з основами – як кислоти
Zn(OH)2 + H2SO4 → ZnSO4 +2H2O
Zn(OH)2 + 2NaOH → Na2ZnО2 + 2H2O
Амфотерні гідроксиди добувають взаємодією розчину солі металу з певною кількістю лугу
ZnCl2 + 2NaOH → Zn(OH)2 + 2NaCl
A12(SO4)3 + 6KOH → 2A1(OH)3 + 3K2SO4
Кислоти
Кислотами називають сполуки, що містять атоми Гідрогену, здатні заміщуватись на атоми металів з утворенням солей.
Кількістю атомів Гідрогену, здатних заміщуватися на атоми металів, визначається основність кислоти.
Розрізняють безоксигенові та оксигеновмісні кислоти.
Безоксигенові кислоти:
HF–флуоридна, або флуороводнева (плавикова) кислота;
НСl – хлоридна, або хлороводнева кислота;
НВг – бромідна, або бромоводнева кислота;
HJ – йодидна, або йодоводнева кислота;
HCN – ціанідна (синильна) кислота;
H2S – сульфідна або сірководнева кислота.
Оксигеновмісні кислоти:
H2SO4 – сульфатна кислота (сірчана кислота);
H2SO3 – сульфітна кислота;
HNO3 – нітратна кислота (азотна кислота);
HNO2 – нітритна кислота;
Н3РО4 – ортофосфатна кислота;
НClO4 – перхлоратна кислота;
НСlО3 – хлоратна кислота;
НСlО2 – хлоритна кислота;
НСlO – гіпохлоритна кислота;
Н3ВО3 – ортоборатна кислота;
H2SiО3 – силікатна кислота.
Дата добавления: 2016-11-22; просмотров: 1242;
