ХІМІЯ Р-ЕЛЕМЕНТІВ. ХІМІЧНІ ВЛАСТИВОСТІ СПОЛУК
КАРБОНУ, НІТРОГЕНУ ТА ФОСФОРУ
Карбон знаходиться в IVА-групі періодичної системи елементів. Електронна формула: 1s22s22p2. У нормальному стані має ступінь окиснення +2, у збудженому стані – +4.
Вуглець – це складова частина нафти, природного газу, кам’яного вугілля. Він зустрічається в природі у вигляді сполук та у вільному стані. Існують чотири алотропічні модифікаціі Карбону: алмаз, графіт, карбін і полікумулен.
У вільному стані Карбон хімічно неактивний; він вступає в реакцію лише з дуже енергійними окисниками. При нагріванні хімічна активність Карбону зростає. З металами та неметалами Карбон реагує лише при високих температурах:
Ca + 2C 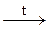 CaC2
4Al + 3C CaC2
4Al + 3C 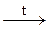 Al4C3
С + S2 ® CS2
C + 2H2 Al4C3
С + S2 ® CS2
C + 2H2 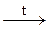 CH4 CH4
| C + O2 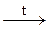 CO2
2C + O2 CO2
2C + O2 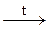 2CO
C + H2O 2CO
C + H2O 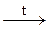 CO + H2↑
C + ZnO CO + H2↑
C + ZnO 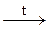 CO↑ + Zn CO↑ + Zn
|
Головними оксигеновмісними сполуками Карбону є оксиди СО (чадний газ) і СО2 (вуглекислий газ). Чадний газутворюється при спалюванні вуглецю або його сполук при нестачі кисню, а також внаслідок взаємодії карбон(IV) оксиду з розжареним вугіллям:
2С + О2 ® 2СО,
СО2 + С ® 2СО.
У лабораторних умовах СО добувають із форміатної кислоти дією на неї концентрованою сульфатною кислотою при нагріванні до 373 К:
.
СО має сильні відновні властивості; при нагріванні здатний віднов-лювати деякі метали з їх оксидів:
CO + 3Fe2O3 ® CO2 + 2Fe3О4 ;
СО + Fe3О4 ® СО2 + 3FeO;
CO + FeO ® CO2 + Fe.
Вуглекислий газ у промисловості одержують при обпалюванні вапняку:
CaCO3 ® CaO + CO2,
а в лабораторних умовах – при дії на мармур хлоридної кислоти:
СaCO3 + 2HCl ® CO2 + H2O + CaCl2.
СО2– кислотний оксид, який взаємодіє з водою, основними оксидами, лугами та амоніаком:
СО2 + Н2О  Н2СО3
Н2СО3
СО2 + СаО ® СаСО3
СО2 + 2КОН ® К2СО3 + Н2О
СO2 + 2NH3 ® CO(NH2)2 + H2O.
При розчиненні у воді СО2 утворюється нестійку слабку карбонатну кислоту H2CO3, у розчині якої встановлюється рівновага:
CO2 + Н2О  H2CO3
H2CO3 


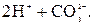
Як двохосновна кислота вона утворює середні (карбонати) та кислі (гідрогенкарбонати) солі. Карбонати і гідрогенкарбонати термічно нестійкі. При нагріванні гідрогенкарбонати переходять у карбонати:
2KHCO3 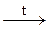 K2CO3 + H2O + CO2.
K2CO3 + H2O + CO2.
Cолі карбонатної кислоти можуть бути отримані при дії на CO2 лугів або за допомогою наступних обмінних реакцій:
КОН + CO2 ® КНСО3;
КНСО3 + КОН ® К2СО3 + Н2О;
ВаCl2 + Na2CO3 ® BaCO3 ¯ + 2NaCl.
Карбонати дуже легко розкладаються під дією мінеральних та слабких органічних кислот
CaCO3 + 2CH3COOH ® Ca(CH3COO)2 + CO2 + H2O.
Усі солі карбонатної кислоти, окрім солей лужних металів, амонію та деяких кислих солей, погано розчиняються у воді.
У сільському господарстві із сполук Карбону використовується для вапнування кислих грунтів вапняк СaCO3; у рослинництві застосовують як інсектицид проти філоксери та деяких комах калій тіокарбонат К2CS3.
Нітроген та Фосфор є елементами VА групи періодичної системи. На зовнішньому енергетичному рівні атомів цих елементів знаходяться п’ять електронів s2p3, із них три р-електрона. Тому в звичайному стані вони мають валентність, яка дорівнює трьом. Ступінь окиснення Нітрогену в його сполуках змінюється в широких межах: від -3 до +5:
| -3 | -2 | +1 | +2 | +3 | +4 | +5 | |
NH3,
 NH4+ NH4+
| NH2– NH2 | N2 | N2O | NO | N2O3 HNO2 | NO2 N2O4 | N2O5 HNO3 |
Внаслідок міцності молекули азот хімічно малоактивний, при кімнатній температурі реагує лише з літієм, утворюючи літій нітрид:
6Li + N2 → 2Li3N
При високих температурах і в присутності каталізаторів Нітроген взаємодіє з неметалами (киснем, вуглецем, бором, кремнієм), досить легко сполучається з деякими металами (Mg, Ca, Ti) з утворенням нітридів:
З неметалами:
N2 + O2 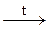 2NO↑
2В + N2 2NO↑
2В + N2 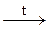 2BN
3Si + 2N2 2BN
3Si + 2N2 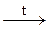 Si3N4 Si3N4
| З металами: N2 + 3Mg → Mg3N2 N2 + 3Ca → Ca3N2 |
Взаємодією азоту з воднем при підвищених температурі та тиску (Т = 450-500°С, Р = 30 мПа) в присутності залізного каталізатора в промисловості синтезують амоніак:
N2 + 3H2 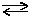 2NH3
2NH3
У лабораторії амоніак отримують нагріванням суміші амоній хлориду з кальцій гідроксидом:
2NH4Cl + Ca(OH)2 → 2NH3↑ + 2H2O + CaCl2
У хімічному відношенні амоніак доволі активний і виявляє лише відновні властивості:
4 NH3 + O2 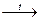 4NO + 6H2O
4NH3 + 3O2 4NO + 6H2O
4NH3 + 3O2 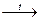 2N2 + 6H2O 2N2 + 6H2O
| NH3 + Са → СаNН + H2 2NH3 + 3Cl2 → N2 + 6HCl |
Амоніак легко розчиняється у воді з утворенням амоній гідроксиду – слабкої основи:
NH3 + H2O 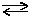 NH4OH
NH4OH
З аніонами кислот іон амонію утворює тверді кристалічні добре розчинні речовини – солі амонію:
NH4OH + Н2SO4 → (NH4)2SO4 + 2H2O
2NH3 (надл.) + H3PO4 → (NH4)3РО4
NH3 + H2O + CO2 → NH4HCO3
Сухі амонійні солі при нагріванні розкладаються на амоніак та кислоту (цей процес називається термічною дисоціацією):
NH4Cl → NH3 + HCl
З Оксигеном Нітроген утворює ряд оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5. Нітроген (III) оксид – кислотний оксид, який легко поглина-ється лугами утворюючи нітрити:
N2O3 + 2NaOH → 2NaNO3 + H2O
Дією на нітрити розведеною сульфатною кислотою утворюють нітритну кислоту:
2NaNO2 + H2SO4 → 2HNO2 + Na2SO4
Нітритна кислота HNO2 – кислота середньої сили, яка існує лише в дуже розведених водних розчинах. При нагріванні ця кислота розклада-ється:
2HNO2 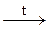 NO2 + NO + H2O.
NO2 + NO + H2O.
Нітритна кислота і її солі нітрити мають окисно-відновні властивості, Нітрити доволі стійкі і добре розчинні у воді.
Нітроген (V) оксид N2O5 має сильні окисні властивості. При розчиненні у воді він утворює сильну нітратну кислоту:
N2O5 + Н2О ® 2HNO3.
У водному розчині нітратна кислота дисоціює майже повністю:
HNО3 → H+ + NО3-
Вона реагує з оксидами та гідроксидами, з солями і неметалами:
2HNO3 + CaO → Ca(NO3)2 + H2O
2HNO3 + Ca(OH)2 → Ca(NO3)2 + 2H2O
2HNO3 + CaСO3 → Ca(NO3)2 + H2O + СО2↑
5HNO3 + Р → Н3РО4 + 5NO2↑ + H2O
6HNO3 + S → 6NO2↑ + Н2SО4 + 2H2O
4HNO3 + 3C → 4NO + 3CO2 + 2H2O
При взаємодії нітратної кислоти з металами утворюється сіль; водень, як правило, не виділяється: він окиснюється, утворюючи воду. Кислота в залежності від її концентрації та активності металу, може відновлюватись до сполук:
HNO3 → NO2 → HNO2 → NO → N2O → N2 → NH3(NH4NO3).
Нітроген – один із хімічних елементів-органогенів, необхідних для росту і життєдіяльності рослин. Незважаючи на те, що повітря містить 79% азоту, існує досить серйозна проблема його нестачі у грунті, внаслідок якої спостерігається затримка росту, ненормальний розвиток та інші хвороби рослин. Молекули органічних речовин, що містять азот, виявляють функціональну активність по відношенню до безлічі реакцій живої клітини, а також структуроутворюючу здатність.
Солі нітратної кислоти (нітрати) використовуються у сільському господарстві як добрива. Нітрати кальцію, калію, амонію та кальцію називають селітрами.
Фосфор належить до поширених у природі хімічних елементів. Він входить до складу білків, тому без нього не можуть існувати живі організми. В рослинах він зосереджений у плодах та насінні. Внаслідок своєї високої хімічної активності у вільному стані не зустрічається. У зв’язку з тим, що Фосфор у природних сполуках знаходиться в найвищому ступені окиснення (+5), для одержання у вільному стані його необхідно відновити. У ролі відновника використовують вуглець:
Ca3(PO4)2 + 5C + 3SiO2 → 3CaSiO2 + 2P + 5CO↑
Фосфор утворює декілька алотропних модифікацій, найважливіші з них: білий (отрута), червоний і чорний фосфор.
При взаємодії з металами виявляє окисні властивості:
3Ca + 2Р → Сa3P2
В реакціях з активними неметалами (киснем, галогенами, сіркою) Фосфор виступає як відновник.
4Р + 5О2 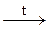 2Р2О5
2Р + 5Сl2 → 2PCl5
2Р + 3S → P2S3 2Р2О5
2Р + 5Сl2 → 2PCl5
2Р + 3S → P2S3
| 4Р + 3О2 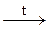 2Р2О3
2Р + 3Сl2 → 2PCl3
2Р + 5S → P2S5 2Р2О3
2Р + 3Сl2 → 2PCl3
2Р + 5S → P2S5
|
З воднем фосфор безпосередньо не взаємодіє, але утворює летку при звичайній температурі сполуку – фосфін PH3. Це безбарвний, отруйний газ. За аналогією з амоніаком він взаємодіє з сильними кислотами, утворюючи солі фосфонію:
PH3 + HClO4 → PH4ClO4
Фосфін – сильник відновник. На повітрі окиснюється до ортофосфатної кислоти:
PH3 + 2О2 → Н3РО4
Фосфор утворює з киснем ряд оксидів, серед яких головними є Р2О3 і Р2О5. Фосфор (III) оксид Р2О3 – кислотний оксид, який при взаємодії з водою утворює фосфітну кислоту:
Р2О3 + Н2О → 2Н3РО3
Фосфітна кислота – кислота середньої сили, що має окисно-відновні властивості:
Н3РО3 + 3Zn + 3H2SO4 → РH3 + 3ZnSO4 + 3H2O
Н3РО3 + Cl2 + H2O → Н3РО4 + 2HCl
Фосфітна кислота утворює два типи солей – кислі (гідрогенфосфіти) та середні (фосфіти). Більшість солей фосфітної кислоти нерозчинні у воді.
Фосфор (V) оксид Р2О5 одержують при повному згорянні фосфору у присутності повітря або кисню:
4P + 5O2 → 2Р2О5
Р2О5 – у хімічному відношенні кислотний оксид, це типовий ангідрид групи фосфорних кислот:
Р2О5 + Н2О → 2НРО3 – метафосфатна кислота
Р2О5 + 2Н2О → Н4Р2О7 – дифосфатна кислота
Р2О5 + 3Н2О → 2Н3РО4 – ортофосфатна кислота
Найважливішою з усіх кислот фосфору є ортофосфатна кислота – кислота середньої сили:
Н3РО4 + 3СаО → Са3(РО4)2 + 3Н2О
Н3РО4 + КОН → КН2РО4 + Н2О
Н3РО4 + 2КОН → К2НРО4 + 2Н2О
Н3РО4 + 3КОН → К3РО4 + 3Н2О
3СаСО3 + 2Н3РО4 → Са3(РО4)2 + 3Н2О + 3СО2↑
Фосфор належить до елементів-органогенів і відіграє дуже важливу роль у обміні речовин. Він входить до складу протоплазми живої клітини, хромосом, вітамінів, ферментів; бере участь в утворенні білків та вуглеводів у рослинних організмах.
У сільському господарстві щироко застосовуються фосфорні добрива, найголовнішими із яких яких є наступні:
CaSO4 + Ca(H2PO4)2 – проcтий суперфосфат
Ca(H2PO4)2 – подвійний суперфосфат
(NH4)2HPO4 + NH4H2PO4 – aмофос
CaHPO4 × 2H2O – преципітат
Дата добавления: 2016-11-22; просмотров: 1329;
