Необоротні та оборотні реакції
Реакції, які відбуваютъся лише в одному напрямку i завершуються повним перетворенням вихідних реагуючих речовин у кінцеві речовини, називаються необоротними.
Більшістъ реакцій є оборотними. Оборотними називаються такі, реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
У рівняннях оборотних реакцій між лівою та правою частинами ставлять дві стрілки, спрямовані у протилежні боки, наприклад:
N2 + 3Н2 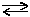 2NH3, ΔН = -92,4 кДж/моль.
2NH3, ΔН = -92,4 кДж/моль.
У техніці оборотні реакції невигідні, тому різними методами (зміна температури, тиску тощо) їx роблять практично необоротними, вони відбуваються у прямому напрямку.
Реакції відбуваються у одному напрямку (необоротні) за умов, коли:
– продукти, що утворюються, виходять зі сфери реакції (випадають у осад, виділяються у вигляді газу):
ВаСl2 + H2SO4 → BaSO4↓ + 2HC1
Na2CO3 + 2НСl → 2NaCl + CO2↑ + H2O;
– утворюєтъся малодисоційована сполука, наприклад, вода:
НСl + NaOH → NaCl + Н2О;
– реакція супроводжуєтъся виділенням великої кількocmi енергії, наприклад, горіння магнію;
Mg + 1/2О2 → MgO; ΔН = - 602,5 кДж/моль.
У piвнянняx необоротних реакцій між лівою і правою частинами ставлять знак piвнocmiабо стрілку.
Хімічна рівновага. Принцип Ле Шательє
Оборотні реакції не доходять до кінця i завершуються встановленням xімічної рівноваги.
Xiмічнy рівновагу можна визначити як такий стан системи реагуючих речовин, за яким швидкості прямої i зворотної реакцій дорівнюють одна одній 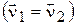 .
.
У стані рівноваги пряма та зворотна реакції не припиняються. Тому така рівновага називається рухомою, або динамічною рівновагою.
У стані рівноваги концентрації ycix реагуючих речовин – як вихідних, так i тих, що утворюються, – залишаються чітко сталими.
Концентраціїреагуючих речовин, які встановлюються при хімічній piвновазі, називаються рівноважними.Вони позначаються у квадратних дужках, наприклад, [H2],[N2],[NH3], тоді як нерівноважні концентрації  позначають так: с(Н2), c(N2), c(NH3).
позначають так: с(Н2), c(N2), c(NH3).
Наприклад: СО + NO2 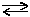 СО2↑ + NО,
СО2↑ + NО,
для прямої реакції 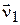 = k1[CO][NO2];
= k1[CO][NO2];
для оборотної реакції 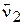 = k2 [CO2][NO]. Стан xiмічної рівноваги
= k2 [CO2][NO]. Стан xiмічної рівноваги 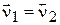 , тобто
, тобто
k1[CO][NO2] = k2[CO2][NO].
Представимо цю piвність у вигляді пропорції:
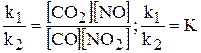
Величина К називається константою хімічної рівноваги. Вона не залежить від концентрації реагуючих речовин і є сталою за даної температури. Для будь-якої рівноважної системи
mA + nB 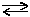 pC + gD
pC + gD

Це рівняння є математичним виразом закону діючих мас у стані рівноваги.
Для гетерогенних реакцій у виразі константи рівноваги концентрації речовин, які перебувають у твердій фазі, не беруть до уваги, тобто концен-трація твердих речовин дорівнює одиниці.
Величина К залежить від природи реагуючих речовин i від температури, aле не залежить від каталізатора.Присутність каталізатора у системі лише прискорює час встановлення рівноваги.
Напрямок зміщення xімічної piвноваги при зміні концентрації реагуючих речовин, температури i тиску визначається принципом рухомої рівноваги, або принципом Ле Шательє: якщо на систему, яка перебуває у стані рівноваги, чиниться будь-який зовнішній вплив (змінюється концентрація, температура, тиск), то він сприяє перебігу цiєї з двох протилежних реакцій, яка послаблює цей вплив.
При зміні концентрації компонентів рівноважної системи значення константи рівноваги залишається незмінним. Якщо у реакційну cyмішввести надлишок однієї з вихідних речовин, то рівновага зміщується в бік продуктів реакції, тобто праворуч. Аналогічний ефект може бути досягнутий шляхом видалення із системи продуктів реакції. При підвищенні температури у системі посилюється ендотермічний процес. При зниженні температури починають переважати екзотермічні процеси.
Вплив тиску визначається зміною об'єму, що відбувається під час реакції. При збільшенні тиску piвновaгa буде зсуватись у бік утворення меншої кількості речовини (молей) газу, а зменшення тиску зміщує рівно-вагу в бік утворення більшої кількості речовини (молей) газу.
Якщо ж у рівнянні оборотної реакції число молей у лівій частині дорівнює числу молей у правій частині, наприклад, N2 + О2 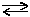 2NO, тоді зміна тиску не спричинить зміщення xімічної piвноваги.
2NO, тоді зміна тиску не спричинить зміщення xімічної piвноваги.
Слід зазначити, що уci каталізатори однаковою мipoю прискорюють як пряму, так i зворотну реакції, i тому на зміщення рівноваги вони не впливають, а тільки сприяють швидкому її досягненню.
РОЗЧИНИ
Розчин-це гомогенна (однорідна) система, яка складається з двох або більше компонентів (розчинника, розчиненої речовини) і продуктів їх взає-модії.
Для кількісної оцінки вмісту розчиненої речовини використовують такі способи вираження концентрації розчинів: масова частка розчиненої речовини, молярна, нормальна і моляльна концентрації.
Масова частка розчиненої речовини(w) - це фізична величина, що до-рівнює відношенню маси розчиненої речовини (mрозч.реч.) до маси всього розчину (mрозчину). Її визначають у частках одиниці або у відсотках.
| w = mрозч. реч. / mрозчину . |
Молярна концентрація (СМ) розчиненої речовини - це фізична вели-чина, що визначається відношенням кількості розчиненої речовини до об’єму розчину.
СМ = 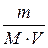 , ,
|
де СМ – молярна концентрація речовини; V – об’єм розчину, л; m – маса речовини, M – молярна маса речовини).
Нормальна концентрація (СН)– це фізична величина, що визначається числом моль-еквівалентів розчиненої речовини, яка міститься в 1 л розчину.
СН = 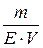 , ,
|
де СН – нормальна концентрація речовини; V – об’єм розчину, л; Е – екві-валентна маса розчиненої речовини.
Моляльна концентрація (Сm) показує, яка кількість розчиненої речо-вини припадає на 1 кг розчинника в даному розчині. Одиниці вимірюван-ня: моль/кг.
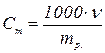 , ,
|
де Сm – моляльна концентрація розчину; n – число молів розчиненої речо-вини; mр. – маса розчинника, кг.
Дата добавления: 2016-11-22; просмотров: 1388;
