ЗВ'ЯЗОК СТАНДАРТНОЇ ЗМІНИ ЕНЕРГІЇ ГІББСА РЕАКЦІЇ З КОНСТАНТОЮ РІВНОВАГИ. РОЗРАХУНОК DrG И DrG0.
Якщо в момент змішання газів, що вступають у реакцію
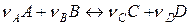 ,
,
парціальні тиски (концентрації) кожного учасника дорівнюють одиниці (всі речовини вступають у реакцію у своїх стандартних станах), те рівняння ізотерми Вант-Гоффа перетворюється в рівняння для розрахунку енергії Гіббса в стандартних умовах:
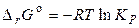 .
.
Воно характеризує здатність різних речовин вступати в хімічну взаємодію й не залежить від шляху процесу, а визначається тільки природою речовин. Знак Dr o указує на напрямок мимовільного процесу, що протікає в стандартних умовах. Ніж більше негативна ця величина, тим більше Кр, тим глибше йде процес. При рівновазі величина Dr дорівнює нулю, тобто подальша мимовільна зміна в системі виключено.
Стандартний ізобарний потенціал хімічної реакції (або хімічна спорідненість речовин) дорівнює ізобарному потенціалу хімічної реакції
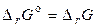 (20)
(20)
за умови, що парціальні тиски всіх речовин реакції, рівні рo = 1 атм = 101325 Па.
У загальному випадку (для реальних і ідеальних систем) справедливо:
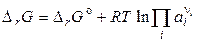 ,
,
де ai – активність компонента або відношення парціального тиску газу до стандартного тиску (ai – безрозмірна величина) тобто
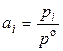 . (21)
. (21)
Величину 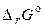 при Т = 298.15 До знаходять на підставі довідкових даних:
при Т = 298.15 До знаходять на підставі довідкових даних:
1) 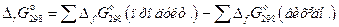 , де
, де 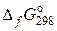 – стандартна вільна енергія Гіббса утворення речовини.
– стандартна вільна енергія Гіббса утворення речовини.
2) 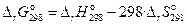 .
.
Аналогічно проводять розрахунок 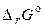 при інших температурах з урахуванням температурної залежності ентальпії й ентропії реакції:
при інших температурах з урахуванням температурної залежності ентальпії й ентропії реакції:
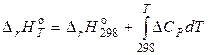 , (22)
, (22)
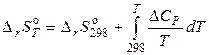 . (23)
. (23)
При відомих значеннях 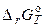 і початкових парціальних тисках або активностях речовин, що беруть участь
і початкових парціальних тисках або активностях речовин, що беруть участь 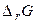 у реакції, розрахунок проводять по формулах:
у реакції, розрахунок проводять по формулах:
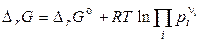 , (24)
, (24)
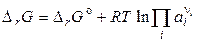 . (25)
. (25)
Дата добавления: 2016-06-02; просмотров: 1189;
