РОЗРАХУНОК ХІМІЧНОГО ПОТЕНЦІАЛУ
Для системи, що складає з однієї речовини, справедливо:
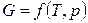 ,
, 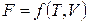 .
.
Якщо система складається з декількох компонентів, то
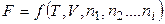 , (46)
, (46)
 , (47)
, (47)
де ni – число молів i-го компонента. Будь-яка екстенсивна функція стану є функцією кількості речовини в системі.
Продиференцуємо (46) і (47) по ni:
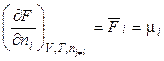 , (48)
, (48)
 , (49)
, (49)
де μi – хімічний потенціал i-го компонента в системі. Його ще називають парціальною мольною енергією Гіббса (парціальна термодинамічна функція Гіббса) або парціальною мольною енергією Гельмгольца (парціальна термодинамічна функція Гельмгольца), тому що 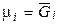 й
й 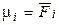 .
.
Можна дати наступне визначення хімічного потенціалу:
хімічний потенціал дорівнює збільшенню енергії Гіббса (або будь-якої іншої характеристичної функції) при збільшенні маси даної речовини на 1 моль, якщо маси всіх інших речовин, температура або тиск ( або інші природні змінні для інших функцій) залишаються постійними.
Будь-яка енергетична характеристика є добуток інтенсивного фактора на екстенсивний. У нашім випадку μi – інтенсивний параметр, а ni – екстенсивний.
Тоді
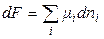 при V, T = const,(50)
при V, T = const,(50)
 при T, p = const. (51)
при T, p = const. (51)
Введення деякої кількості dni молей i-го компонента при постійній кількості інших компонентів і постійних Т и р буде збільшувати значення енергії Гіббса на величину 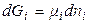 . Аналогічні зміни будуть викликані додатком інших компонентів. Загальна зміна енергії Гіббса системи дорівнює:
. Аналогічні зміни будуть викликані додатком інших компонентів. Загальна зміна енергії Гіббса системи дорівнює:
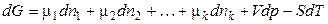 , (52)
, (52)
або, у загальному випадку,
 , (53)
, (53)
яке одержало назву фундаментального рівняння Гіббса.
Для будь-якої хімічної реакції:
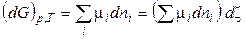 , (54)
, (54)
де  (
( 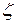 – хімічна змінна або ступінь протікання реакції).
– хімічна змінна або ступінь протікання реакції).
При р, Т = const для хімічної реакції вірно:
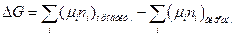 . (55)
. (55)
Розрахунок хімічного потенціалу:
1. Для 1 молячи ідеального газу.Для індивідуальної речовини 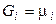 й
й 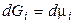 , тоді при Т = const
, тоді при Т = const
d = Vdp-Sd = Vdp, (56)
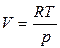 і
і  , (57)
, (57)
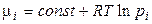 , (58)
, (58)
де рi – тиск індивідуального газу. Звичайно const розраховують при Т = 298 К и рo = 1,013·105 Па, тогда
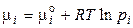 . (59)
. (59)
2. Для суміші ідеальних газів:
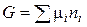

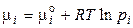 , (60)
, (60)
де рi – парціальний тиск i-го газу, і 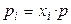 , де
, де 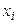 – мольна частка i-го газу в суміші, p – загальний тиск у системі. Звідси
– мольна частка i-го газу в суміші, p – загальний тиск у системі. Звідси
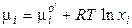 . (61)
. (61)
3. Для суміші реальних газів. Зі збільшенням тиску й зниженням температури гази усе більше стають неідеальними, тобто перестають підкоряться рівнянню стану ідеального газу. Тому для реального газу у вираження хімічної термодинаміки замість парціального тиску (рi) підставляють летючість (фугитивность fi ). Чисельно летючість виражається як 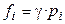 , де γ - коефіцієнт летючості, що характеризує ступінь відхилення газу від ідеальності. Тоді
, де γ - коефіцієнт летючості, що характеризує ступінь відхилення газу від ідеальності. Тоді
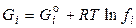 , (62)
, (62)
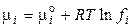 . (63)
. (63)
4. Для ідеальних і реальних розчинів. У неідеальних розчинах концентрація перестає бути величиною, що однозначно визначає властивості розчину, тому концентрацію заміняють активністю. Введенням активності формально враховується взаємодія між молекулами розчинника, ефект сольватації й т.п. Активність можна назвати ефективною концентрацією, при якій ідеальний розчин здобуває термодинамічні властивості даного реального розчину. Тоді: для ідеальних розчинів
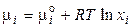 ; (64)
; (64)
для реальних розчинів
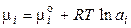 , (65)
, (65)
де 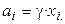 й
й 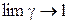 при
при 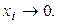
Термодинаміка хімічної рівноваги. Константа хімічної рівноваги. Закон діючих мас. Принцип Ле-Шателье. Ізотерма хімічної реакції. Зв'язок стандартної зміни енергії Гіббса реакції з константою рівноваги. Рівновага в гетерогенних реакціях. Вплив температури на хімічну рівновагу. Рівняння ізобари й ізохоры хімічної реакції.
Дата добавления: 2016-06-02; просмотров: 870;
