РОЗРАХУНОК ЗМІНИ ЕНЕРГІЇ ГІББСА В ХІМІЧНИХ РЕАКЦІЯХ.
Протікання будь-якої хімічної реакції в ізобарно-ізотермічної умовах визначається двома факторами. Перший фактор – ентальпійний ( 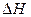 ) – визначає зміна енергії системи. Другий фактор – ентропійний (
) – визначає зміна енергії системи. Другий фактор – ентропійний ( 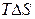 ) – визначає зміна невпорядкованості системи. Таким чином, протіканню хімічної реакції сприяє зменшення енергії системи й перехід її в більше неупорядкований стан.
) – визначає зміна невпорядкованості системи. Таким чином, протіканню хімічної реакції сприяє зменшення енергії системи й перехід її в більше неупорядкований стан.
Енергія Гіббса пов'язана з ентальпією і ентропією: 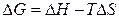 . У будь-якій закритій системі при постійному тиску й температурі можливий такий мимовільний процес, що веде до зменшення енергії Гіббса. Отже, умовою принципової можливості протікання хімічної реакції є нерівність:
. У будь-якій закритій системі при постійному тиску й температурі можливий такий мимовільний процес, що веде до зменшення енергії Гіббса. Отже, умовою принципової можливості протікання хімічної реакції є нерівність: 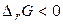 . У випадку, коли
. У випадку, коли 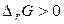 , мимовільне протікання реакції неможливо. Якщо
, мимовільне протікання реакції неможливо. Якщо 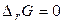 , система перебуває в стані хімічної рівноваги.
, система перебуває в стані хімічної рівноваги.
Внески ентропійного й ентальпійного факторів значно залежить від температури. При 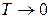
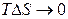 и.
и. 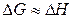
Домінуючим є ентальпійний фактор, тому при низьких температурах, як правило, протікають мимовільно екзотермічні реакції.
При 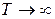
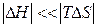 и.
и. 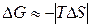
Домінуючим є ентропійним фактор, тому при високих температурах , як правило, мимовільно протікають реакції, що ведуть до збільшення ентропії.
Таким чином, при аналізі можливості мимовільного протікання хімічної реакції необхідний одночасний облік ентальпійного й ентропійного факторів.
Зміна енергії Гіббса в ході хімічної реакції можна розрахувати як різниця між сумою стандартних енергій Гіббса утворення продуктів реакції й сумою стандартних енергій Гіббса утворення вихідних речовин:
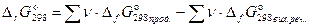 , (45)
, (45)
де ν - стехіометричні коефіцієнти, з якими вихідні речовини й продукти реакції входять у термохімічне рівняння реакції.
Стандартна енергії Гіббса утворення простих речовин, що перебувають у найбільш стійкому в стандартних умовах фазовому стані, дорівнює нулю.
Таблиця 1. Оцінка можливості протікання хімічної реакції.
| Знак зміни функції. | Можливість протікання хімічної реакції. | Приклад хімічної реакції. | ||
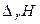
| 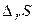
| 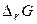
| ||
| – <0 | + >0 | – <0 | Реакція можлива в будь-якому інтервалі температур. | 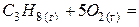
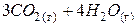
|
| + <0 | – <0 | + >0 | Реакція неможлива в будь-якому інтервалі температур. | 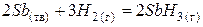
|
| – <0 | – <0 | 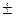 >0
<0
>0
<0
| Реакція можлива лише при низьких температурах, коли 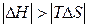 . .
| 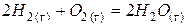
|
| + >0 | + >0 | 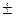 >0
<0
>0
<0
| Реакція можлива лише при високих температурах, коли 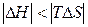 . .
| 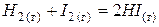
|
Дата добавления: 2016-06-02; просмотров: 1683;
