Розрахунок зміни ентропії в ході мимовільних (необоротних) процесів.
Для необоротних процесів 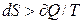 і рівняння (2.4) не застосовне. Ентропія – функція стану і її зміна не залежить від шляху процесу, а визначається кінцевим і початковим станом системи. Зміна ентропії в будь-якому нерівновагому процесі можна обчислити, заміняючи його деякою сукупністю рівноважних процесів, що відбувається між тими ж початковими й кінцевими станами, для кожного з яких можна розрахувати значення
і рівняння (2.4) не застосовне. Ентропія – функція стану і її зміна не залежить від шляху процесу, а визначається кінцевим і початковим станом системи. Зміна ентропії в будь-якому нерівновагому процесі можна обчислити, заміняючи його деякою сукупністю рівноважних процесів, що відбувається між тими ж початковими й кінцевими станами, для кожного з яких можна розрахувати значення  . Тоді:
. Тоді:
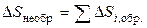 . (14)
. (14)
Для будь-якої речовини при будь-якій температурі можна визначити й абсолютне значення ентропії, якщо скористатися постулатом Планка (третій закон термодинаміки): ентропія правильно утвореного кристала чистої речовини при температурі абсолютного нуля дорівнює нулю.
Абсолютним значенням ентропії речовини при температурі Т називається значення ентропії, обчислене згідно з постулатом Планка (тобто розраховане від нуля, якому дорівнює ентропія при Т = 0 К). Абсолютне значення ентропії додатне. Коли температура прямує до абсолютного нуля, не тільки ентропія прямує до нуля, а й її похідні за всіма термодинамічними параметрами. Це означає, що поблизу абсолютного нуля всі термодинамічні процеси відбуваються без зміни ентропії. Це твердження називають тепловою теоремою Нернста.
Для розрахунку абсолютного значення ентропії речовин у стандартному стані потрібно знати залежності теплоємності Ср від температури для кожної з фаз, а також температури та ентальпії фазових переходів. Наприклад, абсолютне значення ентропії речовини в газоподібному стані при температурі Т може бути обчислена по формулі:
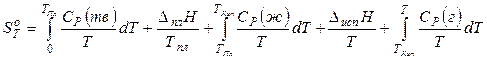 .
.
У термодинамічних таблицях звичайно наводять значення абсолютної ентропії в стандартному стані при температурі 298 К.
Дата добавления: 2016-06-02; просмотров: 1064;
