Розрахунок ентропії для рівноважних (оборотних) процесів.
Другий закон термодинаміки у вигляді 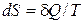 , записаний для рівноважних процесів, дозволяє обчислити не абсолютне значення ентропії, а тільки різниця ентропій у двох станах системи.
, записаний для рівноважних процесів, дозволяє обчислити не абсолютне значення ентропії, а тільки різниця ентропій у двох станах системи.
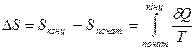 . (4)
. (4)
а) Ізотермічні процеси (T = const).
При постійній температурі протікають процеси фазових перетворень речовин: плавлення, випаровування і інші. Розглянемо для 1 моля речовини при рівноважному протіканні цих процесів тиск зберігається звичайно постійним, тому 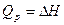 і
і
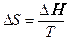 , (5)
, (5)
де 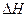 – ентальпія фазового переходу.
– ентальпія фазового переходу.
Ентропія при фазових переходах змінюється стрибкоподібно. При цьому якщо фазовий перехід відбувається в напрямі зростання температури, ентропія також зростає, а при зворотних процесах( конденсація, кристалізація) зменшується.
б) Ізобарні процеси (р = const).
Якщо нагрівання відбувається при постійному тиску, то
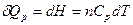 , (6)
, (6)
де n – число молів речовини. Тоді
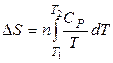 . (7)
. (7)
с) Ізохорні процеси (V = const).
Якщо нагрівання відбувається при постійному об'ємі, то
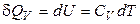 . (8)
. (8)
Тоді
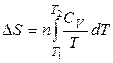 . (9)
. (9)
Для 1 молячи ідеального газу справедливо:
а) При зміні об'єму й температури
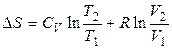 , (10)
, (10)
с обліком, що 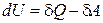 .
.
б) При зміні тиску й температури
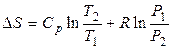 . (11)
. (11)
(12)
Дата добавления: 2016-06-02; просмотров: 1034;
