Термодинамічні константи рівноваги.
У випадку реальних систем рівноважні концентрації у вираженні (5) заміняють на рівноважні активності (аi) і одержують термодинамічну константу хімічної рівноваги:
 , (6)
, (6)
де ni – стехіометричні коефіцієнти рівняння реакції. Величини 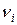 позитивні для продуктів реакції й негативні для вихідних речовин.
позитивні для продуктів реакції й негативні для вихідних речовин.
Константи хімічної рівноваги, виражені через рівноважні парціальні тиски рi або рівноважні фугитивності fi учасників реакції, мають вигляд:
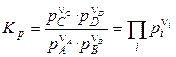 , (7)
, (7)
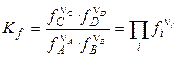 . (8)
. (8)
Наведені вище рівності для констант рівноваги виражають закон, що був сформульований К. Гульдбергом і П. Вааге – закон діючих мас, тобто відношення добутку рівноважних парціальних тисків (концентрацій) продуктів реакції, узятих у ступенях, рівних їх стехіометричним коефіцієнтам, до такого ж добутку рівноважних парціальних тисків (концентрацій) вихідних речовин при даній температурі є величина постійною, називаною константою хімічної рівноваги. Одним з важливих висновків із закону дії мас полягає у встановленні взаємозв'язку парціальних тисків (або концентрацій) всіх речовин, які беруть участь у реакції. В умовах рівноваги парціальні тиски (або концентрації) всіх речовин, що беруть участь у реакції, зв'язані між собою. Не можна змінити парціальний тиск (або концентрації) жодного з них, щоб це не спричинило такої зміни парціальних тисків (або концентрацій) всіх інших речовин, що беруть участь у реакції, що не привело б до колишнього чисельного значення константи рівноваги за даних умов.
Знайдемо зв'язок між КР і КС для реакцій між ідеальними газами. Виразимо рівноважні парціальні тиски за допомогою рівняння Менделєєва-Клапейрона:
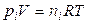

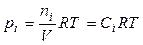 . (9)
. (9)
Тоді, на підставі рівнянь (5) і (7), маємо
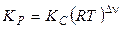 , (10)
, (10)
де ∆ν- зміна числа молей газоподібних речовин у ході реакції.
Дата добавления: 2016-06-02; просмотров: 1205;
