ІЗОТЕРМА ХІМІЧНОЇ РЕАКЦІЇ.
Рівняння ізотерми (або просто ізотерма) хімічної реакції дозволяє зв'язати можливий напрямок хімічної реакції з вихідною сполукою реагуючих речовин. При дослідженні хімічних процесів частіше користуються величиною DG, що є індикатором реакційної здатності речовин у процесах при Т, р = const.
Зміна енергії Гіббса в ході протікання хімічної реакції між газоподібними речовинами дорівнює
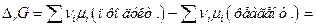
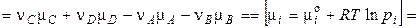
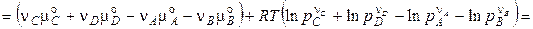
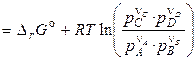 . (12)
. (12)
При настанні рівноваги в системі 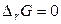 , тоді
, тоді
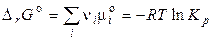 , (13)
, (13)
де 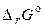 — стандартна зміна енергії Гіббса хімічної реакції (коли всі речовини перебувають у стандартних умовах). Виходить,
— стандартна зміна енергії Гіббса хімічної реакції (коли всі речовини перебувають у стандартних умовах). Виходить,
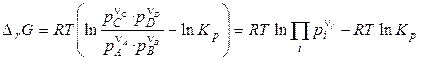 , (14)
, (14)
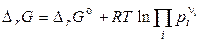 , (15)
, (15)
де pi — початкові (задані) парціальні тиски учасників реакції.
Останні рівняння називають рівняннями ізотерми хімічної реакції або рівняннями Вант–Гоффа. Вони виражають залежність Dr від сполуки системи, тобто залежність між термодинамічним потенціалом реакції Dr, константою хімічної рівноваги (Кp) і умовами проведення реакції.
По рівнянню ізотерми хімічної реакції можна розрахувати зміна енергії Гіббса при відповідних умовах, тобто визначити можливість, напрямок і межа протікання мимовільного процесу. Щоб мимовільно здійснювалася пряма реакція, зміна енергії Гіббса (Dr) повинне бути негативним, а це можливо за умови:
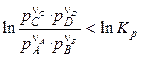 . (16)
. (16)
Якщо
 , (17)
, (17)
те мимовільно піде зворотна реакція.
При встановленні рівноваги:
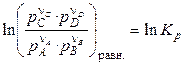 , (18)
, (18)
де pi — рівноважні парціальні тиски учасників реакції.
Аналогічним способом одержують вираження для зміни енергії Гельмгольца для процесів, що протікають при T, V = const:
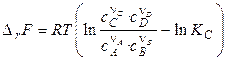 . (19)
. (19)
Дата добавления: 2016-06-02; просмотров: 975;
