РІВНЯННЯ ІЗОХОРИ Й ІЗОБАРИ ХІМІЧНОЇ РЕАКЦІЇ.
Продиферинцуємо рівняння ізотерми хімічної реакції (4.15) по температурі:
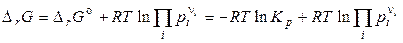 ,
,
 . (26)
. (26)
Підставимо отриману похідну 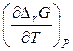 в рівняння Гіббса – Гельмгольца
в рівняння Гіббса – Гельмгольца
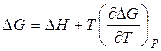
і після скорочення подібних членів одержимо співвідношення:
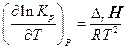 , (27)
, (27)
що устанавлюває зв'язок між зміною константи рівноваги з температурою й тепловим ефектом реакції, що протікає при постійному тиску. Це співвідношення називають рівнянням ізобари хімічної реакції або ізобарою Вант-Гоффа.
Для процесів, що протікають при постійному об'ємі, можна за аналогією одержати рівняння ізохоры хімічної реакції або ізохоры Вант-Гоффа:
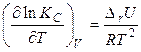 . (28)
. (28)
Рівняння (27) і (28) у диференціальній формі виражають зміна константи рівноваги з температурою й називаються рівняннями Вант-Гоффа. Згідно із цими рівняннями вплив температури на константу рівноваги визначається знаком ентальпії реакції DrН або зміною внутрішньої енергії DrU. Наприклад, при проведенні реакції в умовах сталості тиску:
якщо DrН < 0 (екзотермічна реакція), то підвищення температури зменшує величину КР (мал. 1), зміщаючи рівновагу реакції вліво, тобто убік утворення вихідних речовин;
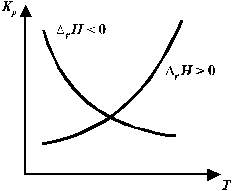 |
якщо DrН > 0 (ендотермічна реакція), то ріст температури приводить до збільшення КР (мал. 1), зміщаючи рівновагу реакції вправо.
Рис. 1. Вплив температури на величину константи
рівноваги хімічної реакції.
Для кількісної оцінки впливу температури на константу рівноваги рівняння ізобари (ізохори) (27) і (28) необхідно інтегрувати в необхідному інтервалі температур (наприклад, уважаючи тепловий ефект у цьому інтервалі температур постійним і рівним стандартному). Після інтегрування одержуємо наступне рівняння:
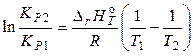 , (29)
, (29)
де  й
й 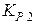 – константи рівноваги при T1 і T2,
– константи рівноваги при T1 і T2, 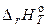 – середній тепловий ефект реакції в інтервалі температур від Т1 до Т2. На підставі рівняння (29) можна також розрахувати константу рівноваги при будь-якій температурі, якщо відомі тепловий ефект хімічної реакції і константа рівноваги при якій-небудь одній температурі.
– середній тепловий ефект реакції в інтервалі температур від Т1 до Т2. На підставі рівняння (29) можна також розрахувати константу рівноваги при будь-якій температурі, якщо відомі тепловий ефект хімічної реакції і константа рівноваги при якій-небудь одній температурі.
Дата добавления: 2016-06-02; просмотров: 4140;
