Лабораторна робота 6. Реакції катіонів 4-ї групи
6.1. Ферум (ІІ) та ферум (ІІІ)
6.1.1. Осадження Fe(OH)2(s)таFe(OH)3(s), їх властивості. В окремі пробірки налийте по 2-3 краплі розчинів FeSO4 та FeCl3, у кожну додайте рівний об’єм розчину з с(NH3) = 3 моль/л. Осади відокремте, розділіть на 2 частини й випробуйте їх розчинність у кислоті й у лузі.
Запишіть рівняння реакцій. Чому вживають свіжо приготований розчин FeSO4? Як він змінюється під дією повітря? Знайдіть lg K реакцій утворення гідроксокомплексів феруму. Чому, готуючи розчини Fe (ІІІ), їх підкислюють? Дослідіть залежність розчинності Fe(OH)2(s) та Fe(OH)3(s) від рН за КЛД. Чи в умовах аналізу Fe(OH)3(s) є помітно амфотерним?
6.1.2. Реакція Fe (ІІ)з диметилгліоксимом (діацетилдіоксимом),
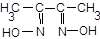 .
.
До розчину FeSO4 додайте кристалик виннокислого натрію, краплю розчину діацетилдіоксиму й 1-2 краплі розчину з с(NH3) = 3 моль/л. Червоне забарвлення розчину обумовлене внутрішньокомплексною сполукою, що, на відміну від сполуки ніколу, розчинна у воді.
Запишіть рівняння реакцій. У чому роль амоніачного середовища? Які реакції феруму (ІІ) маскують тартрати (солі винної кислоти)?
6.1.3. Реакція Fe3+із тіоціанатом.До 2-3 крапель розчину FeCl3 додайте рівний об’єм насиченого розчину NH4SCN, із с(КSCN) = 2 моль/л.
Запишіть Ваші спостереження й рівняння реакцій.
6.1.4. Реакції Fe3+ізK4Fe(CN)6 таFe2+ізK3Fe(CN)6. У одну з пробірок вмістіть 1-2 краплі розчину FeCl3, а в іншу стільки ж розчину FeSO4. У першу додайте 1 краплю розчину K4Fe(CN)6, а в другу − розчинуK3Fe(CN)6.
Порівняйте осади, що утворились. За одними уявленнями – це
K+ + Fe3+ + Fe(CN)64‑ D КFe[Fe(CN)6](s),
K+ + Fe2+ + Fe(CN)63‑ D КFe[Fe(CN)6](s),
де продути не відрізняються один від одного, за іншими – це «берлінська лазур», Fe4[Fe(CN)6]3(s), що утворюється у другому випадку внаслідок попереднього окисно-відновного перетворення,
Fe(CN)63‑ + е‑ D Fe(CN)64‑, Fe2+ – е‑ D Fe3+.
Інтенсивне забарвлення є характерним для сполук, у які той самий елемент входить у різних ступенях окиснення.
6.1.5. Окиснення Fe2+доFe3+. До 2-3 крапель розчину FeSO4 додайте 2‑3 краплі розчину з с(NаОН) = 6 моль/л й 5-10 крапель розчину Н2О2 з масовою часткою 3 %.
Запишіть рівняння реакцій, у тому числі окиснення гідроксиду феруму (ІІ) у гідроксид феруму (ІІІ) в лужному середовищі. Знайдіть їх lg K.
6.2. Бісмут (ІІІ)
6.2.1. Осадження Ві(OH)3(s). До 2 крапель розчину Ві(NО3)3 додайте 3‑4 краплі розчину з с(NH3) = 3 моль/л. Осад, не промиваючи, розділіть на 2 пробірки й перевірте його розчинність у с(HCl) = 3 моль/л та с(NаОН) = 6 моль/л. (Реакції здійснюють також на темній крапельній пластинці).
Запишіть рівняння реакцій (урахувати комплекси Ві3+ із Cl‑). Чи проявляє бісмут (ІІІ) амфотерні властивості?
6.2.2. Утворення хлориду бісмутилу. До 2-3 крапель розчину Ві(NО3)3 додайте 1-2 краплі розчину з с(NH4Cl) = 4 моль/л й розведіть суміш потрійним об’ємом води.
Відзначте колір осаду. Дослідіть його розчинність у с(HCl) = 3 моль/л.
Запишіть рівняння реакцій. Чому розчини солей бісмуту (ІІІ) готують із додаванням відповідних кислот?
6.2.3. Відновлення бісмуту (ІІІ) станумом (ІІ).Повторіть дослід 4.4.2а.
6.2.4. Реакція бісмуту (ІІІ) iз КІ. До 1 краплі розчину Ві(NО3)3 додайте 1 краплю розчину з с(КІ) = 0,5 моль/л. Випадає чорний осад. Додайте ще розчин КІ, перемішуючи, поки осад розчиниться. Розчин розведіть водою, при чому осад утворюється знову.
Запишіть рівняння реакцій. Як впевнитись, що, взаємодіючи з бісмутом, іодид не окиснюється до елементного іоду, що також у розчині жовтий, у осаді темний й розчинний у КІ?
Манган
6.3.1. Осадження Mn(OH)2(s),MnО(OH)2(s) та їх властивості.У 2 пробірки налийте по 1-2 краплі розчину Mn(NO3)2, в одну з них додайте краплю розчину Н2О2 із масовою часткою 3 %, потім у кожну пробірку по 2-3 краплі розчину з с(NH3) = 3 моль/л.
Відзначте різницю у кольорах осадів, відокремте, промийте та подійте розчином із с(НNО3) = 3 моль/л. До того з них, що не розчинився, додайте декілька крапель розчину Н2О2. Чи тепер осад розчинився?
Запишіть рівняння реакцій між формами, що переважають у відповідних областях рН. Знайдіть lg K реакцій.
6.4.3. Реакція стибію (V) з родаміном.На білу крапельну пластинку нанести краплю розчину SbCl3, додайте 2 краплі розчину з с(NаNО2) = 2 моль/л, потім 2 краплі розчину родаміну Б
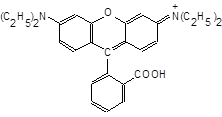
Як впливає NаNО2 на окисний стан стибію? Запишіть рівняння реакцій.
6.3.2. Окиснення Mn2+ до MnО4‑. У пробірку внесіть краплю розчину Mn(NO3)2, додайте дистильованої води до верху пробірки, вміст вилийте й додайте 5 крапель дистильованої води. Краплю розведеного розчину нанесіть на крапельну пластинку, додайте краплю розчину НАс й декілька кристаликів КІО4.
Відзначте колір розчину. Запишіть рівняння реакцій. До якої форми відновлюється тетраоксоіодат (VII)? Яка lg K лінійної комбінації реакцій?
Таблиця 10
Дата добавления: 2016-08-07; просмотров: 717;
