Лабораторна робота 9. Реакції катіонів 6-ї групи
Натрій
| 9.1.1. Мікрокристалоскопічне виявлення Nа+. На сухе предметне скло нанесіть краплю розчину NaCl, випарте, охолодіть. Поряд нанесіть краплю розчину реаґенту діоксоуран(VI) ацетату, UO2Ac2, з’єднайте її з залишками першої краплі. Через хвилину розгляньте під мікроскопом зеленкувато-жовті або безбарвні тетраедричні або октаедричні кристали NaAc × UO2Ac2, що утворились. | 
|
9.1.2. Реакція з кроконатом калію,К2С5О5. До 2-3 крапель розведеного розчину NаNO3 у порцеляновій чашці додайте рівний об’єм розчину кроконату калію,
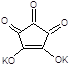
Випарте розчин на піщаній бані. На стінках чашки з’являється червона смужка осаду подвійної солі NаКС5О5.
Повторіть дослід, замінивши NаNO3 на NН4NO3. Чи заважають іони амонію реакції виявлення калію?
Калій
9.2.1. Реакція з гідротартратом натрію,NаНС4Н4О6. До 4-5 крапель розчину КNO3 додайте рівний об’єм розчину NаНС4Н4О6. Щоб пришвидшити утворення білого осаду КНС4Н4О6(s), потріть скляною паличкою внутрішні стінки пробірки або збовтайте її вміст.
Розділивши осад на 4 частини, перевірте його розчинність у гарячій дистильованій воді та розчинах із с(HCl) = 3 моль/л, с(NaOH) = 6 моль/л, с(HAc) = 0,5 моль/л.
Повторіть дослід, замінивши NН4NO3 на КNO3.
Запишіть рівняння реакцій. Використовуючи КЛД для системи КНС4Н4О6(s) ‑ рН, визначте діапазон рН, що є оптимальним для осадження КНС4Н4О6(s).
9.2.2. Реакція зNа3Со(NО2)6. До 1-2 крапель розчину КNO3 додайте рівний об’єм розчину Nа3Со(NО2)6.
Відзначте колір К2NаСо(NО2)6(s). Повторіть дослід, замінивши КNO3 на NН4NO3.
9.2.3. Реакція з тетрафенілборатом натрію. До 1-2 крапель нейтрального або слабко кислого розчину КNO3 додайте рівний об’єм розчину NаВ(С6Н5)4.
Запишіть рівняння реакції осадження КВ(С6Н5)4(s). Повторіть дослід, замінивши КNO3 на NН4NO3. Чи заважає NН4+ виявленню К+ за реакціями 9.2.1 – 9.2.3?
| 9.2.4. Мікрокристалоскопічне виявлення К+. На чисте, сухе предметне скло нанесіть краплю розчину солі К+, випарте насухо, охолодіть й обробіть краплею розчину Na2Pb{Cu(NO2)6}, гексанітрокупрата(ІІ) натрію – плюмбуму. Через хвилину чорні кубічні кристали К2Pb{Cu(NO2)6}, що утворились, розгляньте під мікроскопом. | 
|
Амоній
9.3.1. РеакціяNН4+з гідроксидами натрію або калію. До 2 крапель розчину NН4Cl додайте рівний об’єм розчину NаOН або КОН. Пробірку нагрійте на водяній бані. Не торкаючись стінок, на яких може бути лужний розчин, внесіть стрічку вологого червоного лакмусового паперу у випари. Про що свідчить зміна кольору лакмусового паперу?
Запишіть рівняння реакції.
9.3.2. РеакціяNН4+з реактивом Несслера. До 1-2 крапель попередньо розведеного розчину NН4Cl додайте 1-2 краплі розчину реактиву Несслера. Утворюється червоно-бурий осад (Hg2N)I×Н2О(s).
Нагадуємо, що розчини з вмістом меркурію слід збирати у спеціально призначеній банці.
9.3.3. ВилученняNН4+. Розчин об’єкта, з якого слід вилучити NН4+, вмістіть у чашку, підкисліть декількома краплями розчину з с(НСl) = 12 моль/л, випарте насухо, сухий залишок прожарте, поки сіль амонію, NН4Сl, повністю не сублімується (проба з реактивом Несслера (дослід 9.3.2).
Запишіть рівняння реакції. Яким реакціям виявлення заважає амоній? Як використати вивчену операцію, аналізуючи катіони 6-ї групи?
Таблиця 12
Дата добавления: 2016-08-07; просмотров: 591;
