Лабораторна робота 4. Реакції катіонів 3-ї групи
Алюміній
4.1.1. Осадження Al(OH)3(s), його амфотерність. У пробірку налийте 3 краплі розчину Al(NO3)3 й додайте 3 краплі розчину аміаку. Розчин з осадом поділіть на 2 пробірки. Осади відокремте на центрифузі, промийте. У 1‑у пробірку додайте розчин із с(HNO3) = 3 моль/л, а у 2‑у – розчин із с(NaOH) = 6 моль/л до розчинення. До розчину в 2‑й пробірці додайте рівний об’єм розчину NH4Cl й нагрійте суміш на водяній бані.
Поясніть спостереження за КЛД для системи Al(OH)3(s) - рH. У якому інтервалі рН алюміній (III) практично повністю осаджується? Запишіть рівняння реакцій, ураховуючи утворення аніонних гідрокомплексів та роль NH4+ як катіонної кислоти Бренстеда.
| 4.1.2. Реакція Аl (III) із морином. Нанесіть на цупкий фільтрувальний папір краплю насиченого спиртового розчину (бажано нещодавно приготованого) морину, жовтого барвника з екзотичних дерев, підсушіть й нанесіть | 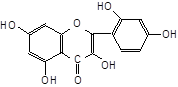
|
на неї краплю розчину Al(NO3)3. Папір опроміньте ультрафіолетовим (УФ) світлом. Відзначте колір флуоресценції лаку Al(OН)3 із морином.
4.2. Цинк (ІІ)
4.2.1. Осадження Zn(OH)2(s) та його амфотерність. Виходячи з розчину Zn(NO3)2, здійсніть операції, вказані у досліді 4.1.1 для Al(OH)3.
Відзначте схожість та різницю у результатах. Які комплекси цинку (ІІ), що не характерні для алюмінію (ІІІ), обумовлюють різницю? Запишіть рівняння реакцій і найдіть їх lg K. Побудуйте КЛД для Zn(OH)2(s) - рН.
4.2.2. Реакцiя Zn (ІІ) із (NH4)2Hg(SCN)4. Пересторога: залишки солей ртутi (отрута!), що входить до складу реактиву, зливати у спецiальний посуд.
На годинникове скло нанесіть по краплi розчинів Zn(NO3)2, розведеного Co(NO3)2, а потiм (NH4)2Hg(SCH)4. Поверхню годинникового скла потріть скляною паличкою. Через декiлька секунд (не бiльше нiж 2 хв) випадає блакитний осад змішаної фази ZnHg(SCN)4(s) та CoHg(SCN)4(s).
4.2.3. Мікрокристалоскопічний варіант реакцiї.На предметне скло нанесіть краплю розчину ZnCl2 та краплю розчину з c(HAc) = 3 моль/л. Трохи нагрійте й обробіть краплею розчину (NH4)2Hg(SCH)4.
. 
| 
|
| Реакція Zn2+ із Hg(SCH)42‑ в присутності Со2+. | Реакція Zn2+ із Hg(SCH)42‑ й невеликої кількості Сu2+, яка надає осадові блакитного забарвлення. Використовують, щоб виявити як Zn2+, так і Сu2+). |
Утворюються характерні кристали − хрести та дендрити. Якщо концентрація Zn2+ мала, то форма кристалів – трикутники та клини. Наявність інших іонів металів змінює вигляд кристалів.
4.2.4. Екстракцiйне вiдокремлення комплексу цинку (II) з тiоціанатом. 3 краплi розчину Zn(NO3)2 пiдкисліть рівним об’ємом розчину з с(HCl) = 3моль/л, додайте 3-4 краплi розчину NH4SCH. Ця сумiш не має бути забарвленою (при рожевому забарвленні через домiшки залiза (III) у реактивах додайте NaF, маскуючи залiзо (III) у стійкі безбарвні комплекси).
До сумiшi додайте рiвний об’єм метилiзобутилкетона й енергiйно перемішайте. Органiчну фазу вiдберіть пiпеткою в окрему пробiрку, куди внесіть рiвний об’єм розчину з с(NH3) = 3 моль/л. Перемiшайте. Вiдберіть водяний шар реекстракта, пiдкисліть його оцтовою кислотою (перевiрте середовище) й виявіть Zn (II), як описано у попередньому пунктi. Аналоґiчнi операції здійсніть із розчином Al(NO3)3 й SnCl2, щоб переконатись, що вони не дають реакцiї. Хром (VI) у кислому середовищi окиснює тiоціанат i заважає реакції, але під час аналізу хром (VI) вiдокремлюють ранiше за цинк (II).
Запишіть рiвняння реакції. Чи можна використовувати екстракцiю i реекстракцiю, щоб концентрувати цинк (II)?
Хром
4.3.1. Осадження Cr(OH)3(s) та його амфотерність.До 3 крапель розчину Cr(NO3)3 у пробiрці додайте 3 краплi розчину амiаку. Розчин із осадом подiліть на 2 пробiрки. Осади відокремте на центрифузі й промийте. До осаду в 1‑й пробiрцi додайте розчин із с(HNO3) = 3 моль/л, а в 2‑й – розчин із с(NaOH) = 6 моль/л до розчинення.
На основi КДД для системи Cr(OH)3(s) − рH поясніть спостереження. Запишіть рiвняння реакцій.
4.3.2. Окиснення хрому (III) до хрому (VI).До 2-3 крапель розчину Cr(NO3)3 у пробiрцi поступово додайте розчин із с(NaOH) = 6 моль/л до розчинення осаду Cr(OH)3(s), що випадає спочатку, а потiм 2-3 краплi розчину H2O2 із масовою часткою 3 %. Пiдiгрiйте сумiш на водянiй банi до переходу кольору розчину в жовтий, властивий іонові CrO42‑.
Зауваження. Щоб визначити можливість окисно-відновного перетворення, розглянемо реакцію, в якій вихідні реагенти та продукти є переважаючими у тій області рН, що реалізується у системі. Наприклад,
| Cr3+ + 4 OH‑ | D | Cr(OH)4‑, | lg b4 = 28,6, | |
| Cr(OH)3 | D | Cr3+ + 3 OH‑, | ‑ lg b3 = ‑24,0, | |
| H2O | D | H+ + OH‑, | lg Kw = ‑14,0 | |
| Cr(OH)3 + H2O | D | Cr(OH)4‑ + H+, | ‑9,4, |
звідки, за ЗДМ,
[Cr(OH)4‑] × [H+] / [Cr(OH)3] = 10‑9,4, [Cr(OH)4‑] / [Cr(OH)3] = 10(‑9,4 + pH),
[Cr(OH)4‑] / [Cr(OH)3] > 1 при pH > 9,4.
Константу перетворення між переважаючими при 9,4 < pH < 11,65 продуктами обчислімо з лінійної комбінації реакцій
| Cr(ОН)4‑ | D | Cr3+ + 4 OH‑, | ‑ lg b4 = 28,6, | |
| Cr3+ + 4 H2O | D | HCrO4‑ + 7 H+ ‑ 6 e‑, | ‑60,8, | |
| HCrO4‑ | D | H+ + CrO42‑, | ‑ lg KH1 = ‑6,51, | |
| H2O2 + 2 H+ + 2 e‑ | D | 2 H2O, | 59,8 | |
| H+ + OH‑ | D | H2O, | -lg Kw = 14,0, | |
| 2 Cr(OH)4‑ + 3H2O2 +2 OH‑ D 2CrO42‑ + 8 H2O, | 242,0. |
При pH > 11,65 переважаючим учасником, замість H2O2, стає HO2‑.
Якi окисники можна запропонувати для окислення хрому (III) у кислому середовищi? Запишіть рiвняння реакцiй i обчислити їх lg K.
| 4.3.3. Реакцiя CrO42‑ із бензидином.На фільтрувальний папір нанесіть краплю попередньо розведеного роз- | 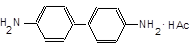
|
чину K2CrO4 (1:20), а поруч краплю оцтовокислого бензидину. На перетині плям утворюється синє забарвлення «бензидинової сині»,
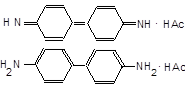
|
Запишіть рiвняння напівреакцій та їх лінійну комбінацію. Простежте аналоґiю з окисненням гідрохінону в хiнгiдрон. Чи є «бензидинова синь» характерною реакцією тiльки на хром (VI)?
4.3.4. Реакцiя CrO42‑ з дифенiлкарбазидом.У пробiрку уведіть краплю розчину К2CrO4, долийте доверху водою й вилийте її вміст. Щоб виявити хром (ІV), достатньо розведеного розчину, що залишився на стінках. Додайте у пробірку 10 крапель дистильованої води, 1-2 краплі розчину із с(H2SO4) = 3 моль/л й розчин дифенілкарбазиду до червоно-фіолетового забарвлення. Продукт окиснення реагенту − дифенілкарбазон, утворює комплекс із незвичним окисним станом, хромом (ІІ),
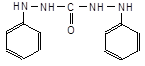
| D | 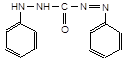
| + 2 H+ + 2 e‑, |
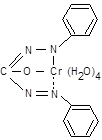
4.4. Станум (ІІ) та станум (ІV)
4.4.1. Осадження Sn(OH)2(s) та Sn(OH)4(s), їх амфотерність.В окремих пробірках до солянокислих розчинів SnCl2 та SnCl4 додайте розчин із с(NaOH) = 6 моль/л до виділення білих осадів. Поділіть кожну з суспензій на дві частини, осади відокремте на центрифузі. Перевірте їх розчинність у кислоті та лузі. Запишіть рівняння реакцій, враховуючи, що у вихідних розчинах станум знаходиться в аніонних хлорокомплексах.
4.4.2. Відновні властивості станума (ІІ).(а) Відновлення бісмуту (ІІІ).До 2 крапель розчину SnCl2 додайте по краплях розчин із с(NaOH) = 6 моль/л, поки осад, що виділився, не розчиниться. В окремій пробірці, змішуючи розчини Bi(NO3)3 та NaOH, отримайте осад Bi(OH)3(s). Змішайте вміст пробірок, відзначте колір осаду.
Запишіть рівняння реакцій перетворення стануму (ІІ) та бісмуту (ІІІ) у відповідні гідроксокомплекси та осад гідроксиду, а також окисно-відновні реакції у лужному середовищі.
(б) Відновлення (NH4)3[PMо12O40], тетрадека‑оксододекамолібдофосфату (VI) триамонію. До 2 крапель розчину NaHPO4 додайте 10 крапель молібденової рідини (розчину (NH4)2MоO4 у азотній кислоті). Після того, як склад пробірки охолодиться, розведіть його, додавши 2 мл дистильованої води, й по краплях додайте розчин SnCl2. З’являється колоїдна «молібденова синь», що містить молібден у різних ступенях окиснення.
Що легше відновлюється: молібден (VI) у вихідній солі або у гетерополікіслотах?
4.4.3. Відновлення стануму (VI).У 2 пробірки внесіть по 5 крапель розчину SnCl4 і по 2-3 краплі розчину з с(HCl) = 12 моль/л. В одну з пробірок вмістіть шматочок металевого цинку, а в другу − заліза. Обидва розчини випробуйте на присутність стануму (II) за однією з вивчених Вами реакцій.
Запишіть рівняння реакцій відновлення хлорокомплексів стануму (VI) й обчисліть їх умовні lg K’.
| 4.4.4. Мікрокристалоскопічна реакція. На ретельно вимите предметне скло мікроскопа нанесіть краплю розчину з с(SnCl4) = = 3 моль/л, додайте краплю розчину з с(NH3) = 3 моль/л й краплю розчину з с(НCl) = 2 моль/л. Предметне скло обережно нагрійте, поки не з’явиться облямівка навколо розчину, SnCl4 + 2 NH4+ + 2 Cl‑ D D (NH4)2SnCl6 (s). Зразок охолодіть, поставте на предметний столик мікроскопу, встановіть збільшення у межах 56 й спостерігайте візуально (можлива фотореґістрація). На фото подано кристали: (а) – через 10 хв. після початку кристалізації; (б) – те ж після 20 хв.; (в) – те ж після 30 хв. | 
|
4.4.3. Реакція стануму (VI) з дитіолом.До 2 крапель розчину SnCl4 в пробірку додайте краплю розчину з с(HCl) = 12 моль/л і по 3 краплі розчину дитіолу. Відзначте колір розчину, обумовлений сполукою
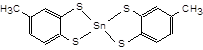
|
4.4.5. Забарвлення полум’я.У чашку внесіть 1-2 краплі розчину солі станума у будь-якому окисному стані, додайте 5-6 крапель розчину з с(HCl) = 12 моль/л й шматочок металевого цинку. У велику пробірку налийте водопровідної води як охолоджуючого засобу. У рідину, що знаходиться в чашці, встроміть дно пробірки і внесіть на деякий час у безбарвне полум’я газового пальника. На дні пробірки з’являються вогники волошково-синього кольору, що бігають. Слід вносити пробірку в кінець полум’я, неглибоко. Заощаджуйте час, інакше весь станум відновиться до метала продуктами неповного згорання газу, й ефект зникне.
Таблиця 9
Реакції катіонів 3-ї аналітичної групи
| Реактиви | Al3+ | Cr3+ | Zn2+ | Sn(II), Sn(IV) |
| NaOH, KOH або NH3, без надлишку | Al(OH)3 ¯, білий ґель | Cr(OH)3 ¯, сіро-зелений або сіро-фіолетовий | Zn(OH)2 ¯, білий | Sn(OH)2 ¯ або Sn(OH)4 ¯, білі |
| NaOH або KOH у надлишку | Al(OH)4‑, безбарвний розчин | Cr(OH)4‑, зелений розчин | Zn(OH)42‑, безбарвний розчин | Sn(OH)3‑, Sn(OH)5‑, безбарвні розчини |
| NH3 у надлишку | Al(OH)3 ¯, білий ґель | Cr(OH)3 ¯, сіро-зелений | Zn(NH3)42+, безбарвний розчин | Sn(OH)2 ¯, або Sn(OH)4 ¯ |
| H2O2 (лужне середовище) | Al(OH)4‑, безбарвний розчин | CrO42‑, жовтий розчин | Zn(OH)42‑, безбарвний розчин | Sn(OH)5‑, безбарвний розчин |
| Н2О2 (середовище HCl) | Al3+ | Н2CrO6, синій розчин | Zn2+ | SnCl62‑, безбарвний розчин |
| Алізарин | Червоний лак | Лак | Лак | Лак |
Таблиця 9 (продовження)
| Реактиви | Al3+ | Cr3+ | Zn2+ | Sn(II), Sn(IV) |
| Дитизон із СCl4 (сильно лужне середовище) | ‑ | ‑ | Малинові розчини у воді й у СCl4 | ‑ |
| (NH4)2{Hg(SСN)4} | ‑ | ZnHg(SCN)4 ¯, білий, у присутності дуже розведеного розчину Со2+– голубий | ‑ | ‑ |
Дата добавления: 2016-08-07; просмотров: 903;
