БІЛКИ ТА АМІНОКИСЛОТИ сільськогосподарських тварин
1. Білки — високомолекулярні органічні сполуки, побудованііззалишків амінокислот. Вони складають структурну і функціональну основу будь-якого живого організму, оскільки з їх діяльністю пов'язане саме існування живої матерії.
В організмі тварини білки виконують ряд життєво важливих функцій: структурну, каталітичну, захисну, транспортну, енергетичну, беруть участь у передачі спадковості тощо. З діяльністю білків пов'язані всі основні прояви життя: подразливість, скоротливість, здатність до росту, розвитку, розмноження, активної регуляції свого складу і функцій, пристосованість до середовища, травлення і виділення кінцевих продуктів обміну.
Білки в середньому становлять 18—21 % загальної сирої маси організму і до 40—50 % його сухої маси. У складі сухої маси органів вміст білків

Білки характеризуються складною будовою молекул і комплексом фізико-хімічних властивостей, що врешті визначає різноманітність їхніх функцій у процесі існування живої матерії.
Елементний склад білків такий, %:
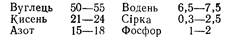
Деякі білки містять у невеликих кількостях (0,3—0,00001 %) також залізо, мідь, марганець, бром, кальцій тощо.
2. Білки — високомолекулярні органічні сполуки. Молекулярна маса білків коливається в широких межах: від кількох тисяч (інсулін — 5700) до сотень мільйонів (білок вірусу грипу — 322 млн.).
Є дві основні форми білків: глобулярна (кулеподібна) і фібрилярна (витягнута). Бувають і перехідні форми, наприклад комплекс актину і міозину — актоміозин. Форма молекули білка змінюється під впливом різних факторів: рН, температури середовища, іонної сили, природи розчинника, концентрації розчину. Довжина білкової молекули середньої молекулярної маси досягає кількох десятків нанометрів (рис. 17).
Фібрилярні білки виконують звичайно структурну і скоротливу функції, глобулярні — метаболічні.
Більшість білків розчиняється у воді. Вони утворюють ліофільні колоїдні розчини, для яких типові такі властивості: молекулярно-кінетичні, оптичні та електрокінетичні.
Прояви молекулярно-кінетичних властивостей колоїдних розчинів білків пов'язані з розмірами і переміщенням колоїдних часточок у середовищі, рН розчину, температурою навколишнього середовища тощо. Колоїдні розчини білків мають низький коефіцієнт дифузії, низький осмотичний тиск (0,273—0,364 Па), але високу відносну в'язкість і великий ступінь набрякання (білки зв'язують близько 80—90 % усієї води організму).
Оптичні властивості колоїдних розчинів білків зумовлені відношенням колоїдних часточок до проходження променів світла крізь розчин. Розчини білків звичайно каламутні Вони здатні розсіювати промені світла (ефект Тиндаля), опалесціювати (в прохідному світлі набувають червонуватого, у відбитому — синього забарвлення). Контури колоїдних часточок видно в ультрамікроскопі (явище ультрамікроскопії) і в електронному мікроскопі.
Електрокінетичні властивості колоїдних розчинів білків визначаються наявністю в їхніх частинках подвійного електричного заряду (адсорбційний і дифузний шари). Між величинами позитивного і негативного зарядів виникає дзета-потенціал. Якщо ї, == 0, настає ізоелектричний стан і колоїдна частинка седиментує (седиментація — самовільне осідання). Ізоелектричний стан настає при різних значеннях рН: у яєчного білка, наприклад, при рН = 4,8, у гемоглобіну — при рН == 6, 7, у міозину — при рН = 5. Значення рН, при якому настає ізоелекгричний стан, визначає ізоелектричну точку.
Для колоїдних розчинів білків характерні два стани: рідкий (золі) та драглеподібний (гелі). Під час обміну речовин перехід одного стану певних ділянок клітини в інший є оборотним процесом. В міру старіння клітини закономірність такого переходу порушується і настає явище синерезису — процесу необоротного утворення твердого гелю і рідкого золю.
Під впливом факторів зовнішнього і внутрішнього середовища білки можуть випадати в осад — коагулювати. Коагуляцію використовують для виділення та вивчення білків у біологічних рідинах:
сироватці крові, лікворі, лімфі, сечі, молоці.
Процес, зворотний коагуляції (осад білка, що випав, переводиться в розчинний стан), називається пептизацією. При цьому усувається коагулянт, колоїдна часточка білка відновлює свій подвійний електричний шар і сольватну оболонку.
Захисні властивості білків характеризуються золотим числом. Золотим числом називається та кількість захисного колоїду (у міліграмах), яка достатня для того, щоб запобігти зміні кольору 10 см3 червоного золю золота на фіолетовий при добавлянні 1 см3 10 %-го розчину NaCl. Чим менше золоте число, тим сильніша захисна дія колоїду
Захисні властивості білків біологічних рідин використовують для характеристики реакційної здатності білків організму при багатьох хворобах.
Білки — амфотерні електроліти. У молекулі білка містяться аміногрупи — NH2 і карбоксильні групи —СООН.
Під час дисоціації карбоксильних груп білок набуває властивостей слабкої кислоти:
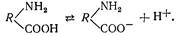
Іони водню можуть приєднуватися до аміногруп білкової молекули; білок набуває властивостей слабкої основи:
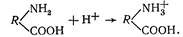
Найчастіше білкова молекула має вигляд амфіонаї
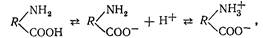
що забезпечує високу реакційну здатність білків. Так, у кислому середовищі білок реагує як катіон, у лужному він має властивості аніона:
Амфотерність білків має велике значення для підтримання в тканинах і клітинах рН на потрібному рівні, оскільки білки виконують роль буферних систем.
3. Хімічний склад білків встановлюють різними методами, основним з яких є гідроліз. Розрізняють кислотний, лужний та ферментативний гідроліз.
При кислотному гідролізі білок вміщують на 6—20 год у 5—10-кратний об'єм 1 н. розчину AgCl або НС1 при температурі 100— 110 °С. Лужний гідроліз проводять за тих самих умов у 2 н. розчинах лугів. Для ферментативного гідролізу застосовують протеолітичні ферменти- пепсин, трипсин, хімотрипсин Кінцевими продуктами гідролізу е амінокислоти та простетичні (небілкові) групи Уявлення про склад білків можна одержати при зіставленні результаів трьох видів гідролізу.
4. Амінокислоти — основні продукти гідролізу білків. У наш час вдалося виділити понад 20 так званих «природних» амінокислот.
Утворення з 100 г сухого білка понад 100 г амінокислот зумовлене приєднанням під час гідролізу до залишків амінокислот води.
Амінокислоти є похідними карбонових кислот, у радикалі яких один чи кілька атомів водню заміщені на аміногрупи. Це безбарвні кристалічні речовини, солодкі на смак, більшість з них розчиняються у воді, оптично активні (крім гліцину), мають високу температуру плавлення (220—315 °С), належать до L-ряду, амінокислоти D-ряду містяться в деяких антибіотиках і оболонках мікробів.
Амінокислоти мають високу хімічну активність. Вступають у багато які хімічні реакції як за —NH2-, так і за —СООН-групами, зокрема взаємодіють з лугами:
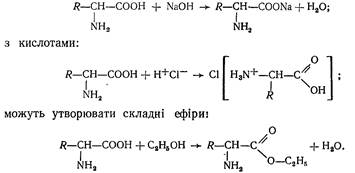
Для амінокислот характерні реакції декарбоксилування:
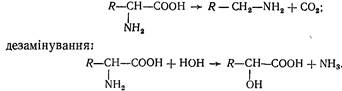
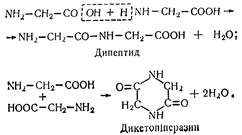
Амінокислоти можуть утворювати пептиди
Амінокислоти утворюють комплексні солі з багатьма металами міддю, цинком, свинцем тощо:

Амінокислоти поділяють на дві групи: ациклічні і циклічні. В групі ациклічних амінокислот виділяють чотири підгрупи: моноаміномонокарбонові, моноамінодикарбонові, діаміномонокарбонові та діамінодикарбонові амінокислоти.
Циклічні амінокислоти поділяють на дві підгрупи: ізоциклічні та гетероциклічні.
Моноаміномонокарбонові амінокислоти. Молекули цієї підгрупи амінокислот мають одну — NH2- і одну —СООН-групи.
Гліцин (глікокол, амінооцтова кислота) NH2—CH2—COOH.Солодка на смак. Синтезується в тканинах організму і утворюється під час гідролізу білків кормів. Бере участь у біосинтезі глутатіону, гіпурової кислоти, порфіринів, креатину тощо.
L - А л а н і н (а-амінопропіонова кислота) часто трапляється у складі білків. Є основою для біосинтезу серину і цистеїну;
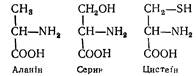
Аланін та його похідні (серин, цистеїн, фенілаланін, тирозин, триптофан, гістидин) становлять 60—65 % усіх амінокислот білків. Синтезується в тканинах організму і утворюється під час гідролізу білків кормів. Аланін — сировина для утворення коензиму А, пантотенової кислоти, карнозину та ансерину. У тваринних тканинах міститься b-аланін N4—CH2—CH2—COOH, складова частина ансерину.
L -Серин (a-аміно-b-оксипропіонова кислота) — складова частина багатьох білків Синтезується в організмі тварини і утворється під час гідролізу білків кормів. Похідними його є антибіотики циклосерин і азосерин.
і L - Ц й с т е ї н (a-аміно-b-тіопропіонова кислота). Виділений з гідролізатів білків вовни, рогів та копит у 1890 р. Синтезується в організмі і утворюється під час гідролізу білків кормів. Містить сульфгідрильну групу —SH— обов'язкову частину молекул багатьох ферментів (тіолових). Аміномасляна кислота міститься в багатьох тканинах тваринного організму у вільному стані. Джерело біосинтезу метіоніну і треоніну. В тканинах (особливо в нервовій) міститься g-аміномасляна кислота. Чотири кислоти мають спільну молекулярну основу:
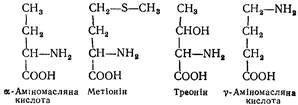
L (—) -Метіонін (a-аміно-b-метилтіомасляна кислота). Виділений з продуктів кислотного гідролізу казеїну в 1922 p. Незамінна амінокислота. Є донором метильних груп, бере участь у біосинтезі холіну, адреналіну, цистеїну та інших речовин.
L (—)-Т р е о н і н (a-аміно-b-оксимасляна кислота). Добутий з гідролізату казеїну і фібрину в 1935 р. Незамінна амінокислота. Має два асиметричних атоми вуглецю (a- і b-положення) і чотири оптичних ізомери.
Y-Аміномасляна кислота утворюється під час декарбоксилування глутамінової кислоти. Є джерелом хімічної енергії в нервовій тканині. Бере участь у процесах гальмування нервового імпульсу.
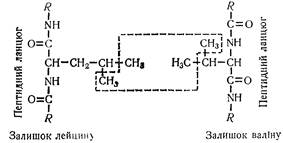
L (+) -Валін (a -аміноізовалеріанова кислота, a -аміно -b - метилмасляна кислота) (СНз)nСН—СH2-CH3)—СООН. Незамінна амінокислота. Високий вміст валіну в еластині (13—14 %) казеїні (7—8 %) і міоглобіні (до 4,1 %).
L (—) -Лейцин (a-аміноізовалеріанова кислота) вперше був добутий з гідролізату м'язової тканини в 1839 р. Входить до складу багатьох білків. Лейцин, ізолейцин та норлейцин мають спільну молекулярну основу;
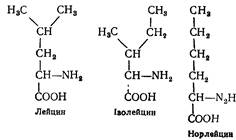
Багаті на залишки лейцину овоальбумін, міозин, казеїн, фібрин. Разом з метіоніном, аспарагіновою кислотою та іншими амінокислотами застосовується при лікуванні анемій.
Ізолейцин (a-аміно- b--метилвалеріанова кислота). Відкритий Ф. Ерліхом у 1904 р. в гідролізаті фібрину. Незамінна амінокислота. Міститься в білках у незначних кількостях.
L (+) -Норлейцин (a-амінокапронова кислота). Синтезований з a-бромкапронової кислоти Е. Фішером у 1900 р. Не виділений з білків і не знайдений у тваринних тканинах у вільному стані.
Моноамінодикарбонові амінокислоти. До складу молекули цієї підгрупи амінокислот входить одна — NH2- і дві — СООН-групи.
L (+) -Аспарагінова кислота (аміноянтарна кислота). Добута з гідролізатів рослинних білків у 1868 р. Синтезується в тваринних тканинах. Білки містять залишки аспарагінової кислоти та її амід — аспарагін:
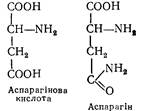
Беруть участь у синтезі сечовини, піримідинових основ, у переамінуванні амінокислот та знешкодженні аміаку.
L (+) -Глутамінова кислота (a-аміноглутарова кислота). Входить до складу багатьох білків та інших сполук (глутатіону, фолієвої кислоти) у вигляді кислоти та її аміду — глутаміну:
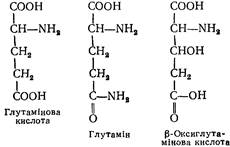 |
Амінокислота та її амід становлять 1/3 усіх вільних амінокислот плазми крові. Бере участь у реакціях переамінування, окислювального дезамінування, декарбоксилування амінокислот, в утворенні g-аміномасляної кислоти, глутатіону, синтезі глюкози та орнітину. Глутамін зв'язує аміак тканин і транспортує його до місця детоксикації (у печінку та нирки). Кислота синтезується в організмі і утворюється під час гідролізу білків кормів. Використовується при лікуванні багатьох нервових хвороб (сировина для синтезу g-аміномасляної кислоти). Особливо багато її в альбумінах і глобулінах крові, колагені.
Діаміномонокарбонові амінокислоти. Містять дві — NH2- і одну —СООН-групи.
L(+)-Орнітин (a,b-діаміновалеріанова кислота). Входить до складу деяких білків печінки. Вільний орнітин трапляється в соках деяких рослин, у зв'язаному стані входить до складу багатьох антибіотиків. Орнітин є складовою частиною орнітинового циклу, в якому знешкоджується аміак.
L (+) -Аргінін (a-аміно-b-гуанідинвалеріанова кислота). Вперше добутий з гідролізату проростків люпину в 1886 p. Входить до складу майже всіх білків. На нього багаті ембріональні тканини і пухлини. Аргінін бере участь в утворенні креатину, в складовою частиною орнітинового циклу:
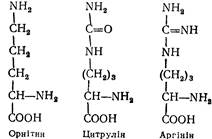
L (+) -Цитрулін (a-аміно-b-уреїдовалеріанова кислота). У складі білків не виявлений. Є складовою частиною орнітинового циклу.
L (+) -Лізин (a, b-діамінокапронова кислота). Вперше добутий з гідролізату казеїну в 1889 р. Незамінна амінокислота. Лізин і оксилізин входять до складу майже всіх білків:
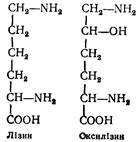
Аміногрупа лізину, розміщена в б-положенні, може приєднувати протон і перетворюватись на групу NH2.
L (+) -Оксилізин (a, b-діаміно-b-оксикапронова кислота). Добутий вперше з гідролізату сполучної тканини в 1938 p.
Діамінодикарбопові амінокислоти. Містять дві —NH2- і дві —СООН-групи.
Цистин (b-дитіоди-a-амінопропіонова кислота). Вперше добутий з сечового піску в 1810 р , в 1899 p.— з гідролізату волосся (кератину). Залишки цистину входять до складу білків, похідних шкіри. Молекула цистину утворюється під час окислення цистеїну:
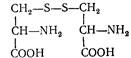
Синтезується в тканинах організму і утворюється під час гідролізу білків корму.
Л а н т і о н і н (S-b-аміно-b-карбоксіетилцистеїн). Вперше виділений з гідролізатів вовни. Залишки лантіоніну входять до складу антибіотиків (лізин, субтилін). За будовою нагадує цистин:
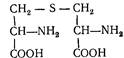
Ізоциклічні амінокислоти. Це похідні бензолу і аланіну. Найбільше значення мають фенілаланін і тирозин.
L (—) -Фенілаланін (a-аміно-b-фенілпропіонова кислота):
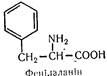
Вперше добутий з проростків люпину в 1879 р. Сировина для біосинтезу гормонів адреналіну, норадреналіну і тироксину. Високим вмістом амінокислоти характеризується інсулін.
L (—) -Тирозин (a-аміно-b-параоксифенілпропіонова кислота):
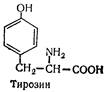 |
Вперше добутий з гідролізату казеїну в 1846 p. Залишки тирозину входять до складу багатьох білків. Сировина для біосинтезу адреналіну, норадреналіну і тироксину.
Гетероциклічні амінокислоти. Амінокислоти цієї підгрупи — похідні гетероциклів індолу та імідазолу і амінокислоти аланіну
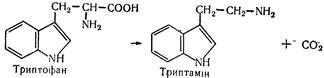
L(—) -Триптофан (a-аміно-b-індолілпропіонова кислота) вперше відкритий в гідролізаті казеїну в 1901 p. Входить до складу багатьох білків. Незамінна амінокислота. Після декарбоксилування триптофану утворюється триптамін:
L (—) -Гістидин (a-аміно-b-імідазолілпропіонова кислота). Відкритий у гідролізаті казеїну і сперми осетра в 1896 p. Багаті на нього гемоглобін (до 10 %), білки печінки та нирок. Гістидиновий залишок входить до складу активних центрів РНКази, хімотрипсину, транскетолази тощо. При декарбоксилуванні гістидину утворюється гістамін:
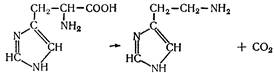
Нестача гістидину в кормах призводить до анемій (гальмується синтез гемоглобіну) і порушень м'язової діяльності.
Імінокислоти. Це карбонові кислоти, що містять іміногрупу —NH. Встановлено тісний зв'язок в обміні імінокислот та переході їх в амінокислоти, і навпаки. У білках містяться дві Імінокислоти: пролін і оксипролін.
L (—) -Пролін (піролідин-2-карбонова кислота). Вперше добутий з гідролізату казеїну в 1901 p. Міститься в усіх білках. Багаті на пролін проламіни (до 10—15 %), колаген, казеїн. Під час окислення проліну утворюється оксипролін:
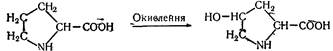
L (—) -Оксипролін (4-оксипіролідин-2-карбонова кислота). Вперше виділений з гідролізату желатину Е. Фішером у 1902р., є складовою частиною еластину, колагену тощо.
5. Структура білків вивчається близько 200 років. Вона відома для ряду білків. Деякі з них синтезовані (наприклад, інсулін, РНКаза).
Хімічні зв'язки в білковій молекулі. Основною структурною одиницею е амінокислоти. Крім груп — СООН та —NHg білки містять інші функціональні групи, які визначають багатогранність їхніх властивостей. До них належать групи, розміщені в бічних відгалуженнях білкової молекули: карбоксильна група аспарагінової або глутамінової кислоти, аміногрупи лізину чи оксилізину, гуанідинова група аргініну, імідазольна група гістидину, гідроксильна група серину і треоніну, фенольна група тирозину, сульфгідрильна група цистеїну, дисульфідна група цистину, тіоефірна група метіоніну, бензольне ядро фенілаланіну, аліфатичні ланцюги інших амінокислот тощо.
Пептидні зв'язки. О.Я. Данилевський (1888 p.), вивчаючи будову білків, встановив наявність у їхній молекулі зв'язків —NH—CO—, які пізніше почали називати пептидними. Вони утворюються в результаті взаємних реакцій між амінокислотами;
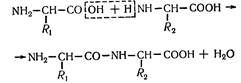
Це підтвердили експериментальне Е. Фішер та його школа. Ними синтезовано понад 200 пептидів, у тому числі нонадекапептид. При найменуванні пептидів закінчення н у назві амінокислоти, яка приєднується, змінюється на -л.
Наприклад, якщо в утворенні дипептиду беруть участь дві молекули гліцину, пептид називають «гліцил-гліцин»:
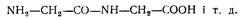
Е. Фішер у перші десятиліття XX ст. створює поліпептидну теорію будови білка, згідно з якою залишки амінокислоти в молекулі білка сполучаються між собою завдяки пептидним зв'язкам, утворюючи гігантські поліпептидні ланцюги У тканинах тварин і рослин знайдені пептиди карнозин, глутатіон та ін.
Встановлюється поліпептидна природа деяких гормонів (вазопресину, окситоцину, інтермедину) та вітамінів (пантотенової і фолієвої кислот). Вводиться новий спосіб найменування поліпептидів — амінокислотний залишок називається першими трьома літерами. Так, тетрапептид гліцил-аланіл-проліл лейцин почали позначати так:
глі-ала-про-лей. Методи рентгеноструктурного аналізу дали змогу визначити в поліпептиді міжатомні віддалі та валентні кути між атомами С, О, Н, N. Дисульфідні зв'язки. Дисульфіди; зв'язки утворюються в молекулі білка в результаті окислення сульфгідрильних груп залишків цистеїну.
Вони «зшивають» два поліпептидних ланцюги і окремі ділянки одного поліпептидного ланцюга в молекулі інсуліну. Трапляються в молекулах багатьох білків: РНКази, колагену, еластину тощо.
Водневі зв'язки. Утворюються між карбонільними (—CO—) та іміно-(—NH—) групами поліпептидних ланцюгів-
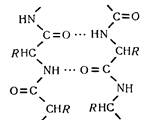
Водневий зв'язок дуже міцний. Його енергія досягає 30 кДж/моль. Водневий зв'язок сполучає поліпептидні ланцюги або окремі їх ділянки.
Гідрофобний зв'язок Вуглеводневі радикали деяких амінокислот (аланіну, валіну та ін ) під дією вандерваальсівських сил зближуються Утворюються симетричні краплі, що мають найменшу поверхню контакту з водою. Завдяки структурі молекули води, яка формується водневими зв'язками, гідрофобні радикали залишків амінокислот відштовхуються. Виникає колоїдна часточка, всередині якої розміщена гідрофобна, зовні — гідрофільна частини молекули білка:
Рівні структурної організації молекули білка. Розрізняють чотири рівні структурної організації молекули білка.
Первинна структура. Залишки амінокислот у молекулі білка сполучаються між собою пептидними зв'язками, утворюючи первинну структуру. Вона залежить від якісного складу амінокислот, їх кількості та порядку сполучення між собою.
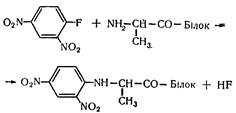
Первинна структура білка найчастіше визначається за Сенгером. Досліджуваний білок обробляють розчином динітрофторбензолу (ДНФ), в результаті утворюється динітрофеніл-білок (ДФН-білок):
У подальшому ДНФ-білок гідролізується, утворюється залишок молекули білка і ДНФ-амінокислота (у даному випадку ДНФ-аланін):
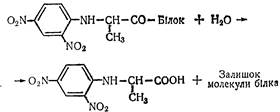
ДНФ-Аланін виділяють із суміші і піддають гідролізу. Продуктами гідролізу є динітробензол і аланін.
Залишок молекули білка вступає в реакцію з новими порціями ДНФ доти, доки вся молекула білка не розпадеться на амінокислоти. На основі кількісного вивчення амінокислот складають схему первинної структури індивідуального білка.
Відомі первинні структури глюкагону, інсуліну, міоглобіну та інших білків.
Вторинна структура. Л. Полінг та Р. Корі в 1951 p., використовуючи рентгеноструктурний аналіз, встановили, що білкові поліпептидні ланцюги найчастіше існують у вигляді a-спіралі, а іноді ,b-структур.
а-Спіраль порівнюють з гвинтовими сходами, де функцію сходинки виконують амінокислотні залишки. стійкість спіралі стабілізується водневими зв'язками
У молекулах фібрилярних білків (фіброїн шовку) поліпептидні ланцюги майже повністю «розтягнуті» (b-структура) і розміщені у вигляді шарів, стабілізованих водневими зв'язками.
а-Спіраль може спонтанно формуватися в синтетичних поліпептидах (нейлон, дедерон), які мають молекулярну масу 10—20 тис. В окремих ділянках молекули білків (гемоглобіну, інсуліну, РНК-ази) порушується а-спіральна конфігурація пептидного ланцюга і створюються спіральні структури іншого типу.
Третинна структура. Спіралеподібні ділянки поліпептидного ланцюга білкової молекули перебувають у різних взаємовідношеннях, які й визначають третинну (тримірну) структуру, створюють об'єм і форму білкової молекули. Вважають, що третинна структура виникає автоматично як наслідок взаємодії амінокислотних радикалів з молекулами розчинника. При цьому гідрофобні радикали «втягуються» всередину білкової молекули, формуючи сухі зони, а гідрофільні групи орієнтуються в бік розчинника, що приводить до створення енергетичне вигідної конформації молекули. Цей процес супроводжується утворенням внутрішньо молекулярних зв'язків.
Третинна структура розшифрована для гемоглобіну лізоциму курячого яйця, РНКази, субодиниць міоглобіну, хімотрипсину тощо.
Четвертинна структура. Цей вид структури молекули білка виникає в результаті асоціації кількох субодиниць в єдину комплексну молекулу Кожна субодиниця має свою первинну, вторинну і третинну структуру Субодиниці прийнято називати протомерами, комплексну частинку — мультимером Об'єднання протомерів у мультимер відбувається самовільно Число протомерів, що входять у мультимер, різне — від чотирьох (у гемоглобіну) до кількох тисяч (у білка вірусу тютюнової мозаїки) Найдетальніше четвертинну структуру вивчено для міоглобіну і гемоглобіну. Молекула гемоглобіну складається з чотирьох субодиниць з молекулярною масою 17 тис. Дві з них належать до а-типу, дві — до b-типу. Субодиниця a-типу містить 141 залишок амінокислот, субодиниця b-типу — 146. Усі чотири субодиниці об'єднуються між собою в мультимер, який має вигляд правильного тетраедра
6. Відомо понад 2000 білків тваринного, рослинного та мікробного походження, їх поділяють на дві групи- прості, або протеїни, і складні, або протеїди Протеїни в результаті гідролізу розщеплюються переважно до амінокислот, протеїди — на простий білок (він, у свою чергу, до амінокислот) і простетичну групу.
Протеїни. Залежно від фізикохімічних властивостей, хімічного складу і значення розрізняють такі протеїни
Альбуміни. До альбумінів належать лактальбумін, сироватковий альбумін, легумелін (гороху) лейкозин (пшениці). Висолюються сульфатом амонію та іншими нейтральними солями лише при 80—100 %-му насиченні розчину Молекулярна маса коливається від 35 тис. до 70 тис. Добре розчиняються у воді та розчинах солей. Виконують пластичні функції в тканинах і клітинах. До складу альбумінів входять лейцин (до 15 %), лізин, аспарагінова і глутамінова кислоти, а також деяка кількість вуглеводів.
Глобуліни. За формою молекул глобуліни належать до глобулярних білків. Розрізняють сироваткові, молочні та яєчні глобуліни. До глобулінів належать міозин, тиреоглобулін, нейроглобулін, ней-ростромін, едестин коноплі, гліциній сої, фазеолін квасолі. Глобуліни висолюються ЗО—50 %-м розчином сульфату амонію. Молекулярна маса — від кількох тисяч до кількох мільйонів. Велике значення мають глобуліни плазми крові: a-, b- і g-. g- глобуліни — носії імунітету, їх використовують для пасивної імунізації проти інфекційних захворювань. Кількісне співвідношення між альбумінами і глобулінами виражають альбуміново-глобуліновим коефіцієнтом. У клінічне здорових тварин він дорівнює 2, зменшується при хворобах. До складу глобулінів входять амінокислоти гліцин (3—4 %), лейцин, валін, лізин, серин, глутамінова кислота, а також деяка частина вуглеводів.
Гістони. Мають молекулярну масу від 5 до 37 тис. Легко розчиняються у воді, при добавлянні розчину аміаку осаджуються, мають основні властивості, зумовлені високим вмістом діаміномонокарбонових амінокислот (20—35 %). До складу гістонів входять аргінін, лізин, гістидин Багаті на гістони тканини залоз внутрішньої секреції (зобна), сперма риб, лейкоцити, еритроцити. За вмістом лізину і гістидину гістони поділяють на кілька фракцій. Гістони утворюють комплексну сполуку з ДНК — нуклеогістон. Приєднання і відщеплення гістону до молекули ДНК регулює біосинтез РНК і білка. Гістони забезпечують унікальну структуру ДНК, є складовою частиною гемоглобіну і багатьох складних білків.
Протаміни відкриті у складі нуклеопротеїдів сперми риб. Виявлені в тканинах багатьох паренхіматозних органів (печінки, селезінки, нирок) та залозах внутрішньої секреції. Молекули протамінів побудовані переважно із залишків діаміномонокарбонових кислот, особливо багаті на аргінін (до 70—87 %). Мають основні властивості, утворюють солі з кислотами. Амінокислотний склад протамінів, наприклад сальміну сьомги, такий: 85 % залишків аргініну, решта серин, пролін, валін, гліцин, ізолейцин та аланін. У ядрах клітин протаміни асоціюють з ДНК. Виконують функції третьої спіралі ДНК, обмотуючи останню ззовні.
Проламіни. Усі проламіни — рослинні білки, цінні продукти харчування: гліадин пшениці і жита, гордеїн ячменю, зеїн кукурудзи, аверин вівса, оризин рису, каферин сорго. Вони важко розчиняються у воді, але добре—в 60—80 %-му етанолі. Добувають їх екстракцією в 70 %-му етанолі з наступною відгонкою спирту у вакуумі. Молекула проламіну на 10—15 % складається з проліну, на 20—50 % — з глутамінової кислоти, інші амінокислоти становлять незначний процент. Проламіни бідні на лізин. Молекулярна маса їх досягає 75 тис.
Глутеліни. Є важливими кормовими і харчовими білками. Містяться в зелених частинах рослин (до 43 % складу білків) і зерні злаків. Розчиняються в розбавлених розчинах лугів і кислот. Молекула глутелінів багата на залишки глутамінової кислоти і лізину. Виділені глутеліни пшениці і кукурудзи, оризенін рису. В зерні пшениці гліадин і глутенін утворюють клейковину, що визначає хлібопекарські якості зерна.
Протеноїди (склеропротеїни). Мають молекулярну масу до 10 тис. Не розчиняються в холодній воді, розчинах лугів, кислот і солей, майже не розщеплюються протеолітичними ферментами, міцні і еластичні. Виконують опорні функції. Речовини, близькі до протеїноїдів, добуті в експериментах, які моделюють походження життя на Землі (О. І. Опарін, 1966).
Колаген — фібрилярний протеїноїд. Молекула колагену складається з трьох поліпептидних ланцюгів, закручених у спіраль. Колаген становить третину білків організму, є основним структурним компонентом сухожиль, зв'язок, хрящів, кісток, основи шкіри, луски риб. Молекули колагену мають ниткоподібну форму завдовжки до 300 і завширшки до 1,5 нм. Для молекули колагену характерна повторюваність групи гліцил-проліл-оксипроліл. При тривалому кип'ятінні з водою колаген утворює желатин. Добувають його на м'ясокомбінатах із сухожиль, зв'язок та інших відходів. Желатин використовується для виготовлення столярного клею, в харчовій промисловості, бактеріології (для середовища), хірургії (при зупинці кровотеч) і т. д.
Кератин — фібрилярний білок. Становить основу епідермісу, вовни, пір'я, рогів, копит, дзьоба. Не розчиняється у воді, розчинах кислот, лугів, солей і в органічних розчинниках.
При тривалому гідролізі з мінеральними кислотами розщеплюється до 7—14 різних амінокислот. Кератин багатий на цистин, лейцин і глутамінову кислоту. Має високу молекулярну масу (до 200 тис.), У складі молекули кератину виявлені скручений (a-спі-раль) і розтягнутий (b-форма) поліпептидні ланцюги.
Еластин — опорний білок еластичних тканин. Становить білкову основу зв'язок, сухожиль, середньої оболонки крупних артерій і вен. Не розчиняється у воді навіть при кип'ятінні. У тонкій кишці частково розщеплюється еластазою. До складу молекули еластину входять гліцин, пролін, валін, лейцин та інші амінокислоти.
Фіброїн — білок шовкової нитки. Стійкий проти гідролізу. Містить до 44 % залишків гліцину, а також аланін і тирозин.
Протеїди розрізняють залежно від природи простетичної групи. нуклео-, хромо-, фосфо-, ліпо- і глюкопротеїди. Іноді до них відносять протеїдні комплекси.
Нуклеопротеїди. Складні білки, що складаються з простих білків і нуклеїнових кислсл Відкриті Ф. Мішером у 1868 р о клітинах гною. Пізніше виявлені в різних клітинах організмів людини, тварин, рослин, мікробах і вірусах. Прості білки представлені гістонами і протамінами, альбумінами і глобулінами. Залежно від природи нуклеїнової кислоти, яка входить до складу нуклеопротеїду, розрізняють дезоксирибонуклеопротеїди (ДНП) і рибонуклеопротеїди (РНП). Будову нуклеїнових кислот розглянуто в попередньому розділі.
Хромопротеїди. Складні білки, молекули яких складаються з простого білко і забарвленої простетичної групи. Простий білок частіше представлений гістонами, простетичні групи — похідними ізо-алоксазину (флавінові ферменти), каротину (родопсин) і порфірину (гемоглобін, міоглобін, гемінові ферменти — каталаза, пероксидаза, цитохргмоксидаза тощо).
Гемоглобін — червоний залізовмісний білок крові. Його молекула складається з білка глобіну і забарвлюючої речовини — гему. Специфічність гемоглобіну для кожного виду тварин визначається хімічною будовою глобіну, оскільки гем для всіх хребетних однаковий. Молекулярна маса білка досягає 68 тис. Молекула гемоглобіну складається з чотирьох субодиниць, кожна субодиниця — з гему і молекули глобіну:
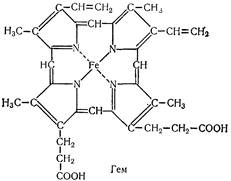
Кожний гем оточений одним з чотирьох поліпептидних ланцюгів глобіну. Молекула гемоглобіну складається з двох симетричних половинок. Кожна половинка має два ланцюги: a- і b-. a-Ланцюг містить 141 амінокислотний залишок, b-ланцюг — 146. Отже, молекула гемоглобіну складається з 574 амінокислотних залишків. Гем сполучений з глобіном через гістидиновий залишок поліпептидного ланцюга. В зібраній у теграмер молекулі всі чотири геми розміщені на поверхні і легко доступні для взаємодії з О3, CO2, CO. Субодиниці сполучаються між собою сольовими, водневими та іншими зв'язками.
Гемоглобін — головний структурний і хімічний компонент еритроцитів.
Міоглобін. Молекула утворена одним гемом і однією молекулою глобіну. Міститься в м'язовій тканині, де депонує кисень і передає його відповідним ферментним системам. Виявляє більшу спорідненість до кисню, ніж гемоглобін. У наземних тварин міоглобін зв'язує близько 10 % усього кисню тканин (у людини — 14 %), У наземних тварин міоглобін становить 2 % сухої маси м'язів.
Молекула міоглобіну є сполученням двох частин: поліпептидного ланцюга, що складається з 153 амінокислотних залишків, і гему
Молекулярна маса міоглобіну — 17 тис. Міоглобін з газами утворює такі самі сполуки, як і гемоглобін (оксиміоглобін, карбоксиміоглобін, метміоглобін).
Фосфопротеїди. Молекули фосфопротеїдів під час гідролізу розщеплюються до простих білків і ортофосфорної кислоти.
Наявність у складі білка залишків кислоти надає білкам кислого характеру. Ортофосфорна кислота в молекулі фосфопротеїду утворює моно- і діефірні зв'язки, а в окремих випадках — пірофосфатні зв'язки, що сполучаюсь поліпептидні ланцюги в білкову молекулу. Найбільше значення мають такі фосфопротеїди.
Казеїн — білок молока і молочних продуктів. Утворюється з казеїногену, від молекули якого при зсіданні відщеплюється пептид. Розчиняється в сольових розчинах. Під дією кислот випадає в осад.
Молекулярна маса казеїну 24—400 тис. Складається з трьох фракцій: а-, р- і у-. Молекула казеїну містить залишки всіх незамінних амінокислот. Казеїн багатий на лейцин, валін, лізин, метіонін і триптофан. Він найцінніший харчовий продукт для новонароджених і молодих тварин, людини, джерело фосфору для утворення кісток, багатьох білків, фосфатидів, макроергів, коензимів.
Пепсин — основний фермент шлункового соку, найкраще діє в слабкокислому середовищі. Розщеплює білки до пептидів, іноді до амінокислот. Молекулярна маса близько 34500. Молекула являє собою довгий поліпептидний ланцюг, який складається з 340 амінокислотних залишків, трьох внутрішніх дисульфідних зв'язків і залишку фосфорної кислоти.
Виробляється головними клітинами залоз дна шлунка у вигляді неактивного пепсиногену, після відщеплення від нього пептиду перетворюється на активний фермент (рис. 23).
До фосфопротеїдів належать білки курячого яйця: овоальбумін — основа білка і білки жовтка; вітелін; вітеленін і фосфовітин.
Ліпопротеїди. Це складні білки, молекула яких складається з простого білка і ліпіду. Ліпопротеїди розчиняються у воді і мало або зовсім не розчиняються в органічних розчинниках. Ліпопротеїди є основою біологічних мембран і пластинчастих структур — мієлінових оболонок нервових волокон, хлоропластів тощо. Трапляються у вільному стані в лімфі, крові, молоці, яєчному жовтку. Утворення ліпопротеїдів забезпечує транспортування і розчинність ліпідів (а також інших речовин) у тканинах і клітинах.
Вітаміни A, D, Е, К і F транспортуються в клітини у вигляді ліпопротеїдних комплексів з a,b-глобулінами плазми крові.
Детально вивчені a- і b-ліпо-протеїди плазми крові. Перші з них становлять близько 3 % білків плазми крові. Їхня молекула на 65 % складається з протеїну і на 35 % — з ліпіду, b-Ліпопротеїди становлять близько 5 % білків плазми крові. Їхня молекула містить Близько 25 % протеїну і 75 % ліпіду. Молекулярна маса перших — близько 200 000, других — 1 300 000.
У молекулах ліпопротеїдів білкова частина сполучається з ліпідом найчастіше іонним зв'язком. Розчинності ліпідів у клітині сприяє структура його молекули, оскільки білкова частина молекули з гідрофільними групами знаходиться зовні, а гідрофобні ділянки розміщуються всередині.
Глікопротеїди. Молекули глікопротеїдів при гідролізі розщеплюються на простий білок і вуглеводну простетичну групу, яка звичайно складається з гіалуронової і хондроїтинсірчаної кислот, гепарину, деяких глікополісахаридів. Під час гідролізу простетичної групи утворюються гексози (маноза, галактоза, глюкоза), гексозаміни (глюкозамін, галактозамін) і кислоти (глюкуронова, оцтова, сірчана). Молекулярна маса — від кількох десятків тисяч до мільйонів. Білки містяться в усіх тканинах. Вміст вуглеводної частини в глікопротеїді варіює від кількох часток процента до 80 %. Зв'язок у молекулі глікопротеїду між білковою частиною і простетичною групою міцний і розщеплюється після тривалого гідролізу. Він формується за рахунок взаємодії вуглеводного компонента з групою — СООН залишку аспарагінової кислоти. Найбільший інтерес становлять муцини і мукоїди.
М у ц и н и — слизові виділення епітеліальних покривів слизових оболонок травного каналу, дихальних і сечостатевих шляхів, слинних залоз. Виконують захисну функцію. Стійкі проти гідролізу.
Мукоїди — глікопротеїди хрящової (хондромукоїди) і кісткової (остеомукоїди) тканин, яєчного білка (овомукоїд), синовії, скловидного тіла ока, зв'язок та сухожиль тощо.
До глікопротеїдів належать гормони передньої частки гіпофізу — тиреотропін і фолікулостимулюючий, групові речовини крові, імуноглобуліни, деякі білки крові і тканин (наприклад, протромбін), ферменти тощо.
| <== предыдущая лекция | | | следующая лекция ==> |
| Поверхневі явища. Адсорбція | | | АГРЕГАТНИЙ СТАН РЕЧОВИН |
Дата добавления: 2016-09-20; просмотров: 3959;
