Поверхневі явища. Адсорбція
1. Будь-яка гетерогенна система, тобто система, що володіє поверхнею розділу фаз, характеризується визначеним запасом поверхневої енергії.
Ця енергія тим більше, чим більше поверхня розділу фаз.
Різні поверхні володіють різною поверхневою енергією, тому для їхнього порівняння введене поняття: питома поверхнева енергія – енергія, що приходиться на одиницю площі поверхні в ізотермічних умовах, при постійному обсязі, вона дорівнює :
F=sS, s=F/S, де
F- ізохорно-ізотемічний потенціал, що відповідає загальній енергії поверхні.
S- площа поверхні.
s- питома ( що приходиться на один квадратний метр) поверхнева енергія.
2. Поглинання якою-небудь речовиною інших речовин називається сорбцією.Сорбція (адсорбція й абсорбція)
Адсорбція - процес йде тільки на поверхні, збільшується концентрація речовини на границі розділу фаз
Абсорбція - речовина, що поглинається, дифундує в глиб поглинача і розподіляє по обсязі.
Адсорбент – речовина, на поверхні якого йде адсорбція.
Адсорбат (адсорбтив) – речовина, що адсорбуєтся (поглинається)
Адсорбція Г виражається кількістю адсорбтива (у моль) адсорбованих на поверхні адсорбенту площею в 1 м.
Г=h/s (моль/м); Г= h/m (моль/кг)
Поверхнева активність і адсорбуємість залежать від природи полярної групи, будови молекули і довжини радикала СН3СООН – розчинна і З5Н11СООН- нерозчинна.
Сили взаємодії адсорбенту й адсорбата, що визначає адсорбцію, різні і звичайно розглядають два крайніх випадки адсорбції.
Фізична відбувається за рахунок сил Ван-дер-Вальса. характеризується гарною оборотністю, енергією, відсутністю стехіометричних співвідношень, зменшенням адсорбції при підвищенні температури. Приклад шляхетний газ- вугілля
Хімічна (хемосорбції) - здійснюється тільки шляхом хімічної взаємодії. Майже необоротна, тепловий ефект близький до енергії утворення хімічних сполук. Підвищення температури сприяє хемосорбції. Приклади: кисень на вольфрамі,  кисень на сріблі.
кисень на сріблі.
Явище фізичної і хімічної адсорбції часто розрізняється лише в крайніх випадках. Звичайно здійснюються проміжні варіанти.
Адсорбція на поверхні роздягнула рідину газ
Гетерогенна система, що представляє собою чисту рідину, що стикається з іншим середовищем, наприклад з її власною парою, характеризується тим, що рідина на поверхні знаходиться в особливих умовах у порівнянні з іншою масою рідини
Внутрішній шар: молекула піддається однаковому впливу з усіх боків, сили міжмолекулярної взаємодії зрівнюються.
Поверхневий шар: взаємодія з молекулами газу набагато менше ніж з рідиною. Молекули прагнуть втягнуться усередину рідини – поверхня розділу рідина - газ прагне до зменшення прагнення вільної енергії до зменшення. (форма кулі в краплі рідини – мінімальна поверхня)
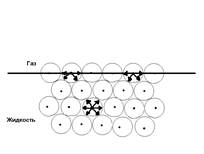
мал. Схема дії міжмолекулярних сил усередині рідини і на її поверхні.
3. Правило Дюкло-Траубе: У будь-якому гомологічному ряду при малих концентраціях подовження вуглеводородного ланцюга на СН2- група збільшує поверхневу активність у 3-3,5 рази.
Правило Траубе справедливо лише при вільному розташуванні адсорбованих молекул у поверхневому шарі паралельно поверхні.
Речовини, додавання яких до розчинника знижують поверхневий натяг, називають поверхово – активними речовинами (ПАР)
Застосування ПАР
Широко застосовуються в різних галузях промисловості.
Навіть дуже малі добавки цих речовин змінюють умови взаємодії дотичних тіл і природу їхньої поверхні.
Це використовується для:
- полегшення руйнування: наприклад, при тонкому шарі речовин
- найтонше розпилення рідини
- дозволяють зменшувати тертя між поверхнями
- послабляють прилипання друг до друга твердих поверхонь
- без добавки ПАР (мила чи ін. засоби) неможливе прання навіть у гарячій воді.
-у якості диспергаторов (активних наповнювачів) твердих речовин. Сажа каолін - підсилюють міцність до зносу, стійкість до температур.
- як емульгатори при виробництві фармацевтичних і косметичних препаратів.
В даний час немає загальної теорії яка досить коректно описала б усі види адсорбції на різних адсорбентах і різних поверхнях роздягнула фаз, по цьому розглянемо найбільш розповсюджені теорії які (незважаючи на велике число допущень) дозволяє на якісному рівні одержати представлення при такому складному процесі як адсорбція.
Теорія молекулярної адсорбції Ленгмюра .
Ізотерма Ленгмюра.
В основі теорії лежать наступні положення:
1. Адсорбція є локалізованої і викликається силами близькими до хімічного.
2. Адсорбція молекул адсорбата відбувається на активних центрах завжди існуючих на поверхні адсорбенту на поверхні кристала вапняного шпату виступу, піки, узвишшя – отут знаходяться активні центри.
3. Активні центри характеризуються великою не насичуваністю силового полючи, завдяки чому на центрах утримується молекули газу, що налітають.
4. Кожен активний центр має малий радіус дії і здатний взаємодіяти лише з однією молекулою адсорбата, утвориться мономолекулярний шар (мономолекулярна адсорбція).
5. Адсорбовані молекули недовго утримуються на активному центрі. Час перебування залежить від температури: при високих t=130-230(C-10 секунд. При низьких t може утримуватися скільки завгодно.
Відривається – ідуть у газову фазу ( десорбція) на їхнє місце – нові
6. Сили взаємодії між адсорбованими молекулами не перевищуються. Тому, що час перебування молекул газу на активних центрах не залежить від того, чи зайняті молекулами газу сусідні активні чи центри ні.
На підставі приведених положень було виведене рівняння ізотерми локалізованою адсорбцією
Г= Гмакс = С/(С+А)
Де Г- адсорбція
С – рівноважна концентрація газу
а- відношення швидкості адсорбції до абсорбції
Це рівняння називається рівнянням ізотерма адсорбції Ленгмюра. Воно показує що при малих концентраціях (С=а) адсорбція пропорційна концентрації, а при високих концентраціях (С=а) адсорбція прагне до граничного значення Гмакс
| <== предыдущая лекция | | | следующая лекция ==> |
| Ітциація поліпептидного ланцюга | | | БІЛКИ ТА АМІНОКИСЛОТИ сільськогосподарських тварин |
Дата добавления: 2016-09-20; просмотров: 1802;
