АГРЕГАТНИЙ СТАН РЕЧОВИН
1.Фізична хімія наука, що пояснює хімічні явища та їх закономірності, базуючись на загальних принципах фізики.
Речовини в залежності від температури і тиску можуть знаходитись в таких агрегатних станах : гази, рідина + тверді, плазміні. Різниця між першими 3 станами речовин в відстані між молекулами і ступенями їх взаємодії. В газоподібному стані молекули речовини знаходиться один від одного на великих відстанях , значно більших, ніж їх розміри. Сили взаємодії між молекулами малі ,а речовина може бути max розряджена, або зжата для переходу в рідину або в твердий стан. Деякі молекули можуть знаходитися як комплекс: 2, 3, 4 і більше молекул.
Ідеальні гази – такі у яких можна знехтувати силами міжмолекулярної взаємодії та власним об’ємом молекул. Фізичний стан ідеальних газів визначається 3 параметрами: температурою, тиском p, V.
Є 3 основні газові закони:
1. Закон Бойля-Маріота;
2-Закон Гей-Люссака і Шарля;
3- Закон Авогадро.
Перший закон (1678 рік) знаходить зв’язок між об’ємом даної молекули ідеального газу і тиском при постійній температурі. Об’єм даної маси газа при постійній температурі зворотньо пропорційний тиску. Якщо Рo та Vo і Р1 та V1- величини тиску та об’єму початкового і кінцевого стану газів, маємо
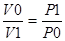 або V0P0=V1P1
або V0P0=V1P1
2-закон (1802р.): вони встановили залежність між V даної маси газа і температури при постійному тиску. Якщо об’єм газівVo та V1-початкові і кінцеві об’єми. При нагріванні на кожний градус об’єм газу збільшується на 1/273,16 від першопочаткового об’єму при нулі градусів, то таке збільшення об’єму газа записується рівнянням:
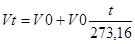 або
або 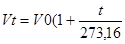
Точка максимального збільшення тиску газу при нагріванні та постійному об’ємі дорівнює
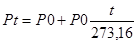 або
або 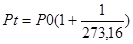
Тому 2-закон формулюється т.ч.: при постійному тиску з підвищенням температури на 1 градус С об’єм даного газу збільшиться на 1\273,16 по відношенню до його об’єму при температурі 0 градусів С. Або при постійному об’ємі зміна температури на1 градус змінює тиск газу на 1\273,16 його тиску при 0 градусів С
3-закон(1811р.): це закон про залежність V різних газів та числа молекул в цих об’ємах.
Дата добавления: 2016-09-20; просмотров: 1140;
