Експериментальна частина
100 мл досліджуваної води відбирають мірною колбою в конічну колбу на 250 мл, додають 1 мл 10%-ного розчину калій хромату і титрують 0,025н. розчином аргентум нітрату до появи буро-червоного забарвлення. Відмічають об’єм розчину аргентум нітрату, який був витрачений на титрування. Титрування повторюють три рази.
Розрахунок вмісту хлорид-йонів проводять за формулою
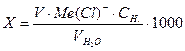 (мг/л),
(мг/л),
де V – об’єм розчину AgNO3, мл; СН. – молярна концентрація еквівалента (нормальна концентрація) розчину AgNO3; Ме(С1-) – молярна маса еквівалента С1- (35,5 г/моль); 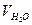 - об’єм досліджуваної води, мл.
- об’єм досліджуваної води, мл.
Результати визначення вмісту йонів С1- представити в табличній формі за зразком:
| № з.п. |  , мл , мл
|  , мл , мл
| 
| Ме(С1-) | Х, мг/л |
| Сер. |
Запитання для самоконтролю
1. До якої категорії належать хлоридні йони в природних водах?
2. Чому хлоридні йони можуть досягати великих концентрацій в природних водах?
3. В яких водах вони переважають?
4. В чому полягає сутність методу визначення хлоридів в природних водах?
ЛАБОРАТОРНА РОБОТА №9.
ФОТОКОЛОРИМЕТРИЧНЕ ВИЗНАЧЕННЯ ФЕРУМУ
Теоретичний вступ
Йони Fe2+ та Fe3+ постійно присутні в поверхневих і підземних водах. Високий вміст Феруму в поверхневих водах вказує на забруднення їх шахтними або промисловими стічними водами. При водопостачанні для питних і водогосподарських потреб високий вміст Феруму у воді спричиняє технічні ускладнення. Гранично допустима концентрація Феруму у питній воді не може перевищувати 0,3 мг/л (додаток, табл.1). Підвищений вміст Феруму у воді надає їй бурого забарвлення і залізистого присмаку. Гранично допустимий вміст Феруму загального та Fe3+ (мг/л) для форелевих господарств складає відповідно 0,5 та 0,1, а для коропових - 2 і 0,2 (додаток, табл.2).
Вміст Феруму у воді визначають колориметричним методом на основі реакції йонів Fe3+ з калій або амоній роданідом. При цьому відбувається реакція
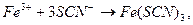
в результаті якої утворюється яскравочервоний ферум(ІІІ) роданід. Інтенсивність забарвлення його пропорційна концентрації йону Fe3+.
Для визначення вмісту Fe2+ його окиснюють до Fe3+.
Цим методом можна визначити 0,05-4,0 мг Феруму в 1 л води з точністю ±0,05 мг/л.
Інтенсивність забарвлення вимірюють на фотоелектроколориметрі.
Фотоколориметричний аналіз ґрунтується на здатності забарвлених розчинів поглинати світло у видимій області спектру (400-700 нм). Інтенсивність поглинання світла пропорційна інтенсивності забарвлення і кількісно характеризується оптичною густиною розчину D.
Відповідно до закону Бугера-Ламберта-Бера оптична густина розчину забарвленої сполуки при однаковій товщині шару прямо пропорційна концентрації розчину.
Якщо виміряні оптична густина DЕТ. еталонного розчину з концентрацією СЕТ. і оптична густина DХ досліджуваного розчину, то

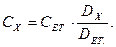
При масових аналізах концентрацію досліджуваного розчину визначають за калібрувальним графіком. Для побудови калібрувального графіка готують серію еталонних розчинів і вимірюють їх оптичну густину.
Експериментальна частина
Готують стандартний розчин з вмістом йонів Fe3+ 0,1 мг/мл або 0,01 мг/мл. Для цього використовують галун Fe(NH4)(SO4)2 . 12H2О, наважку якого 0,8636 г розчиняють у невеликій кількості дистильованої води в мірній колбі на 1 л, додають 2 мл концентрованої хлоридної кислоти (густина 1,19) і доводять розчин дистильованою водою до 1 л (розчин А, Т(Fe3+) = 0,1 мг/мл). Для одержання розчину з вмістом йонів Fe3+ 0,01 мг/мл (розчин Б, Т(Fe3+)= 0,01 мг/мл) 100 мл розчину А доводять дистильованою водою до 1 л.
З стандартного розчину Б готують серію еталонних розчинів в мірних колбах на 50 мл.
Стандартний розчин (Т(Fe3+) = 0,01 мг/мл) заливають у бюретку. В мірну колбу на 50 мл наливають 15-20 мл дистильованої води, додають мірною піпеткою 1 мл розбавленої (1:1) нітратної кислоти (для запобігання гідролізу солі Fe3+ і відновлення Fe3+ до Fe2+ надлишком роданід-йону), точно відмірюють з бюретки необхідний об’єм стандартного розчину і доводять дистильованою водою об’єм до 50 мл, розчин перемішують.
Перед вимірюванням оптичної густини розчин переливають у конічну колбу і мірною піпеткою додають 5,0 мл 10%-ного розчину амоній роданіду.
Для кожного з еталонних розчинів необхідно обчислити: масу Fe3+, мг; масову концентрацію ρ(Fe3+), мг/л; молярну концентрацію СМ(Fe3+), моль/л:
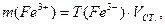
де VСТ. – об’єм стандартного розчину, мл;
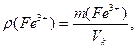
де VК – об’єм колби, л;
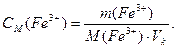
Результати обчислень подати в табличній формі за зразком:
| № еталонного розчину | |||||
| VСТ. | 2,0 | 4,0 | 6,0 | 8,0 | 10,0 |
| m(Fe3+), мг | |||||
| ρ(Fe3+), мг/л | |||||
| СМ(Fe3+), моль/л |
Для кожного з розчинів на фотоколориметрі виміряти оптичну густину з синьо-зеленим світлофільтром (λ=480 нм) в кюветі з товщиною поглинаючого шару 30 мм (l=30 мм). Побудувати калібрувальний графік залежності оптичної густини D від масової концентрації ρ(Fe3+), мг/л, відкладаючи по осі абсцис концентрації, а по осі ординат – відповідну оптичну густину.
Виміряти оптичну густину досліджуваного розчину, приготувавши пробу для аналізу, як для еталонних розчинів.
За калібрувальним графіком визначити концентрацію досліджуваного розчину ρ(Fe3+) і СМ(Fe3+).
Вимірювання оптичної густини повторити 3-4 рази і обчислити середнє значення.
Запитання для самоконтролю
1. До якої категорії належать йони Fe2+ та Fe3+ в природних водах за класифікацією О.Альокіна?
2. На чому засноване фотоколориметричне визначення Феруму в природних водах?
3. На що вказує високий вміст Феруму в поверхневих водах?
4. Яка гранично допустима концентрація Феруму в питній воді і у воді рибогосподарських водойм?
Дата добавления: 2016-05-16; просмотров: 788;
