Энергия Гиббса как критерий самопроизвольного протекания химических процессов
Изменение энтальпии в ходе химической реакции не служит критерием ее направления. Самопроизвольно могут протекать как экзотермические, так и эндотермические реакции, хотя при обычных условиях последние и менее многочисленны.
Функцией, учитывающей совместное влияние энтальпии и энтропии, является энергия Гиббса (G):
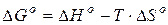 (23)
(23)
где 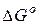 – изменение энергии Гиббса в реакции;
– изменение энергии Гиббса в реакции; 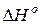 – изменение энтальпии в реакции;
– изменение энтальпии в реакции; 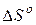 – изменение энтропии в реакции;
– изменение энтропии в реакции; 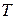 – температура.
– температура.
Изменение энергии Гиббса является мерой устойчивости системы при постоянном давлении.
Критерием принципиальной возможности протекания процессов в закрытых системах при постоянстве температуры и давления, является изменение энергии Гиббса:
1. 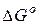 < 0 – самопроизвольное протекание прямой реакции возможно, но практически не всегда может осуществляться из-за кинетических затруднений;
< 0 – самопроизвольное протекание прямой реакции возможно, но практически не всегда может осуществляться из-за кинетических затруднений;
2. 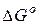 > 0 – самопроизвольное протекание прямой реакции невозможно;
> 0 – самопроизвольное протекание прямой реакции невозможно;
3. 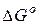 = 0 – в системе наступило химическое равновесие.
= 0 – в системе наступило химическое равновесие.
Рассчитать 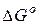 в ходе химической реакции можно двумя способами:
в ходе химической реакции можно двумя способами:
1. 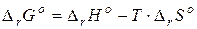 (24)
(24)
2. 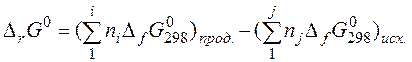 (25)
(25)
где 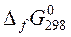 – стандартная энергия Гиббса образования вещества – это изменение энергии Гиббса в реакции образования 1 моль вещества из простых веществ.
– стандартная энергия Гиббса образования вещества – это изменение энергии Гиббса в реакции образования 1 моль вещества из простых веществ.
Дата добавления: 2016-02-09; просмотров: 1454;
