Зависимость скорости реакции от температуры.
При повышении температуры скорость большинства реакций увеличивается. Однако некоторые реакции с увеличением температуры замедляются, например, реакции с участием ферментов. При повышении температуры фермент уменьшает свою каталитическую активность, поэтому скорость реакции тоже уменьшается.
Зависимость скорости реакции от температуры приближенно определяется эмпирическим правилом Вант-Гоффа (выполняется для реакций, протекающих при обычных температурах 273-373К):
при повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2-4 раза:
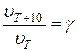 (31) или
(31) или 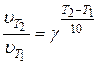 (32)
(32)
где 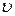 – скорость реакции при определенных температурах; Т – температура;
– скорость реакции при определенных температурах; Т – температура;  – температурный коэффициент реакции, который показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на 10 °C.
– температурный коэффициент реакции, который показывает во сколько раз возрастает скорость реакции (или константа скорости) при повышении температуры на 10 °C.
Поскольку величина скорости прямопропорциональна константе скорости и обратнопропорциональна времени, то формулу (32) можно записать следующим образом:
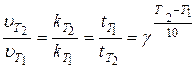 (33)
(33)
где k – константа скорости; t – время протекания реакции.
Более точное описание зависимости скорости реакции от температуры даёт уравнение Аррениуса:
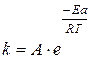 (34)
(34)
где А – постоянный множитель, не зависящий от температуры, связан с вероятностью и числом столкновений;
e – основание натурального логарифма;
R – универсальная газовая постоянная (R=8,314 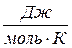 );
);
Т – температура, К;
Еа – энергия активации реакции, Дж.
Для того чтобы между частицами совершился элементарный акт взаимодействия, они должны столкнуться друг с другом. И хотя число столкновений, испытываемых каждой молекулой, очень велико, далеко не каждое приводит к взаимодействию. Возможность и вероятность взаимодействия между молекулами зависит от их состояния в момент столкновения. Хотя в среднем энергия молекул при данной температуре постоянна, есть молекулы, обладающие большим запасом энергии, и, следовательно, большей скоростью движения.
Молекулы, обладающие энергией достаточной для осуществления реакции в данных условиях, называются активными.
Энергия активации (Ea) – минимальный запас энергии, которым должны обладать молекулы, чтобы вступить в реакцию.
Рассмотрим изменение энергии исходной системы при её превращении в конечное состояние (рисунки 1 и 1/)
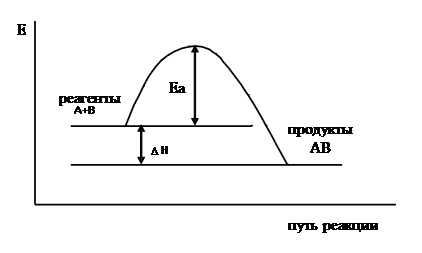
| Рис. 1. Энергетический рельеф пути экзотермической реакции |
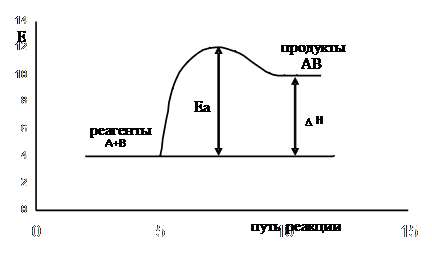
| Рис. 1/. Энергетический рельеф пути эндотермической реакции |
Для образования молекулы АВ (рис.1) молекулы А и В, обладающие энергией, превышающей энергию активации вступают в химическое взаимодействие.
Разность между энергией продуктов реакции и исходных веществ является тепловым эффектом реакции ( 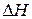 ).
).
Исходя из рис.1 видно, что продукт реакции АВ обладает меньшим запасом энергии, чем исходные вещества, т.е. реакция 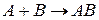 является экзотермической; из рис.1/ видно, что продукт реакции АВ обладает большим запасом энергии, чем исходные вещества, т.е. реакция
является экзотермической; из рис.1/ видно, что продукт реакции АВ обладает большим запасом энергии, чем исходные вещества, т.е. реакция 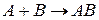 является эндотермической.
является эндотермической.
Таким образом, энергия активации зависит от пути, по которому протекает реакция.
Дата добавления: 2016-02-09; просмотров: 1195;
