III. Качественные реакции на некоторые группы БАВ
Согласно НД, для установления подлинности ЛРС, кроме макро- и микроскопических методов, а также метода ТСХ, широко используется проведение качественных реакций на основные группы БАВ. Ниже приведены основные из них.
1. Полисахариды:
а) крахмал
- реакция с йода раствором. Йод окрашивает амилозу в синий цвет, а амилопектин – в фиолетовый (фармакопейная реакция установления подлинности исландского мха слоевищ);
б) инулин
- реакция с α-нафтола раствором, красно-фиолетовое окрашивание (фармакопейная реакция установления подлинности корневищ и корней девясила);
- с тимола раствором и серной кислотой появляется оранжево-красное окрашивание (фармакопейная реакция установления подлинности корневищ и корней девясила);
- с парами хлористоводородной кислоты дает пурпурную окраску;
- с резорцином в присутствии хлористоводородной кислоты и раствором бензидина в ледяной уксусной кислоте – красное окрашивание;
в) слизи
- с растворами калия гидроксида или натрия гидроксида, аммиака разведенного раствором слизи дают желтое окрашивание (фармакопейная реакция установления подлинности алтея корней);
- реакция осаждения 96% спиртом - образуются хлопьевидные сгустки (фармакопейная реакция установления подлинности подорожника листьев);
- со спиртовым раствором метиленового синего (1:5000) слизь окрашивается в голубой цвет;
- с черной тушью (разведенной водой 1:10) слизь дает неокрашенные белые пятна (гистохимическая реакция);
- реакция двойного окрашивания. Срез помещают на 20 минут в 2% раствор железа (III) хлорида, затем на 2-3 минут в 2% раствор метиленового синего, промывают водой и заключают в глицерин: клетки со слизью окрашиваются в желтый цвет, волокна луба в голубой, сосуды ксилемы в зеленый (гистохимическая реакция).
г) пектиновые вещества
- реакция со спиртовым раствором 5 г/л карбазола в присутствии серной кислоты; при нагревании на водяной бане появляется красно-фиолетовое окрашивание (галактуроновая кислота; фармакопейная реакция установления подлинности подорожника листьев).
2. Фенольные гликозиды (лигнаны и флаволигнаны):
- в УФ-свете лигнаны флуоресцируют голубым или желтым светом;
- при проявлении хроматограмм раствором железа (III) хлорида лигнаны окрашиваются в сине-зеленый цвет.
3. Флавоноиды:
а) цианидиновая проба. К извлечению из ЛРС добавляют хлористоводородную кислоту и металлический магний; при взаимодействии выделяющегося водорода с молекулами флавоноидов образуются оксониевые соединения, имеющие окраску от оранжевой (флавоны) до красно-фиолетовой (флавонолы, флаваноны, флаванонолы).
Халконы, ауроны и изофлавоны окрашивания в цианидиновой реакции не дают, но при добавлении хлористоводородной кислоты (без магния) появляется красное окрашивание за счет образования оксониевых солей.
Следует помнить также, что изменение условий реакции путем замены магния на цинк приводит к изменению окраски на желто-бурую, при этом положительную реакцию дают флавонолы и флаван-3-О-гликозиды, а флаваноны не дают положительной реакции.
Важно отметить также, что эти окрашенные соединения можно фотоколориметрировать (т.е. получить приблизительную количественную оценку содержания отдельных флавоноидов).
б) При добавлении к спиртовому извлечению флавоноидов нескольких капель раствора натрия гидроксида или калия гидроксида наблюдается желтое окрашивание (его дают флавоны, флавонолы, флаваноны), оранжево-красное и пурпурное (ауроны, халконы), либо синее (антоцианы).
в) При добавлении к спиртовому извлечению флавоноидов 2-3 капель 2% спиртового раствора алюминия хлорида протекает реакция комплексообразования с появлением желтого окрашивания яркой зеленой флуоресценции в УФ-лучах. Эта реакция очень наглядна при изучении пятен флавоноидов на хроматограммах в УФ-свете (фармакопейная реакция установления подлинности боярышника листьев).
г) При выявлении флавоноидов часто проводят борно-лимонную реакцию (или реакцию Вильсона-Таубека): 5-оксифлавоны и 5-оксифлавонолы с раствором борной кислотой в присутствии лимонной кислоты дают желтую окраску с красноватой флуоресценцией в УФ-свете. Замена лимонной кислоты на щавелевую ведет к изменению цвета флуоресценции пятен флавоноидов с красноватого на желтый или зеленый.
д) Флавоноиды со свинца (II) ацетата раствором или свинца (II) ацетата основного раствором образуют желтые соли и комплексы (хлопья в растворе выпадают в осадок).
е) Флавоноиды со свободной оксигруппой у С7 легко образуют азокрасители с диазотированной сульфокислотой и другими производными ароматических аминов.
ж) Флавоноиды, как и все фенольные соединения, взаимодействуют с ионами Fe3+ с образованием комплексов, окрашенных главным образом в сине-черный и зелено-черный цвета. Реакция малоспецифична.
з) С сурьмы (III) хлорида раствором 5-оксифлавоны и 5-оксифлавонолы взаимодействуют с образованием комплексных соединений, окрашенных в желто-оранжевый (флавоны) или красно-фиолетовый (халконы) цвет.
и) При хроматографическом разделении суммы флавоноидов из ЛРС на бумаге (или в тонком слое сорбента) смесью бутанол - уксусная кислота - вода (4:1:5) в УФ-лучах (без обработки хроматограмм проявляющими реактивами) наблюдаются желтые, буро-желтые или коричневые пятна, а после проявления хроматограмм спиртовым раствором натрия гидроксида или калия гидроксида – оранжевое или красное свечение (после проявления в парах аммиака – оранжево-коричневое свечение).
Алкалоиды.
Для обнаружения алкалоидов в растительном сырье чаще всего проводят общие реакции (реакции осаждения алкалоидов) и хроматографию. Для обнаружения какой-либо определенной группы алкалоидов проводят специфические цветные реакции, люминесцентный хроматографический анализ и используют другие методы.
Общие реакции на алкалоиды.
Они основаны на способности алкалоидов образовывать нерастворимые в воде соединения с солями тяжелых металлов, с комплексными йодидами, комплексными кислотами и другими соединениями кислотного характера. Эти реакции позволяют установить наличие алкалоидов даже при незначительном их содержании.
Реакции проводят с неочищенным извлечением из ЛРС. Обязательным условием является кислая среда (в щелочной среде осадки не образуются или же образуются за счет разрушения реактивов). Алкалоиды из ЛРС извлекают 1-5% раствором хлористоводородной кислоты или серной кислоты. Реакции проводят с капельно-минимальным количеством реактивов (!): избыток их приводит к растворению осадка.
При добавлении соответствующих реактивов в присутствии алкалоидов тотчас или через некоторое время образуется осадок. Обилие осадка зависит как от количественного содержания алкалоидов, так и от чувствительности их к реактиву. Однако, следует учитывать, что с общими реактивами образуют осадки еще и некоторые другие органические соединения, которые могут содержаться в неочищенных извлечениях (холин, бетаин, белки, продукты их разложения и др.) Поэтому, чтобы получить более достоверные результаты, общие реакции проводят еще и с очищенными извлечениями.
В методическом плане осадочные реакции удобнее всего осуществлять на предметном стекле.
В методологическом отношении осадочные реакции имеют так называемое «отрицательное значение», т.е. позволяют делать выводы об отсутствии алкалоидов в сырье в случае отрицательной реакции с несколькими реактивами.
Наиболее часто используются следующие реактивы:
- Реактив Майера. С большинством алкалоидов в слабокислых и нейтральных растворах этот реактив образует желтый или желтоватый осадок. Чувствительность алкалоидов к этому реактиву весьма различна: стрихнин и бруцин осаждаются в разведении 1:150 000, морфин – 1: 25 000, а кофеин, колхицин реактив Майера не осаждает.
- Реактивы Вагнера и Бушарда (KJ·J
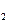 ). С большинством алкалоидов в слабокислых растворах эти реактивы образуют бурые осадки.
). С большинством алкалоидов в слабокислых растворах эти реактивы образуют бурые осадки. - Реактив Драгендорфа (KJ·BiJ
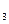 ). Многие алкалоиды в кислых растворах дают оранжево-красные или кирпично-красные осадки.
). Многие алкалоиды в кислых растворах дают оранжево-красные или кирпично-красные осадки. - Реактив Марме. С алкалоидами реактив Марме дает белые или желтоватые осадки, часто растворимые в избытке реактива. Чувствительность некоторых алкалоидов к этому реактиву невелика. Атропин, колхицин, вератрин и некоторые другие алкалоиды осаждаются из сравнительно концентрированных растворов, а кофеин этим реактивом совсем не осаждается.
- Раствор танина. В подкисленных растворах алкалоиды дают с танином беловатые или желтоватые аморфные осадки.
- Раствор кремневольфрамовой кислоты. Большинство алкалоидов весьма чувствительны к этому реактиву и в слабокислых растворах образуют беловатые осадки.
- Раствор фосфорномолибденовой кислоты. Это один из наиболее чувствительных реактивов. С алкалоидами он образует желтоватые осадки, которые через некоторое время приобретают синее или зеленое окрашивание вследствие восстановления молибденовой кислоты.
- Раствор фосфорно-вольфрамовой кислоты. Фосфорно-вольфрамовая кислота со многими алкалоидами дает беловатые осадки.
- Раствор пикриновой кислоты.Пикриновая кислота образует с рядом алкалоидов осадки (пикраты) желтого цвета. Некоторые алкалоиды пикриновой кислотой не осаждаются (кофеин, морфин, аконитин, теобромин), другие же осаждаются только из концентрированных растворов (например, атропин).
- Раствор пикролоновой кислоты. Со многими алкалоидами пикролоновая кислота дает желтые осадки (пикролонаты).
Специфические реакции на алкалоиды.
Если необходимо установить присутствие определенного алкалоида или определенной группы алкалоидов в растительном сырье, проводят специфические реакции (цветные) и микрокристаллоскопические реакции.
Специфические реакции проводят с индивидуальными алкалоидами или с очищенной суммой алкалоидов.
Алкалоиды из ЛРС извлекают 1-5% раствором какой-либо кислоты (хлористоводородной, серной и др.). Кислотное извлечение подщелачивают раствором аммиака (или натрия гидроксида), а затем алкалоиды извлекают органическими растворителями (хлороформом, дихлорэтаном и др.). Органический растворитель отгоняют или выпаривают в фарфоровой чашке и с остатком проводят соответствующие реакции. В качестве специфических реактивов на алкалоиды при проведении реакций окрашивания довольно часто используют:
- серную кислоту,
- азотную кислоту,
- серную кислоту с формалином (реактив Марки),
- серную кислоту с молибдатом аммония (реактив Фреде) и др.
Кроме того, алкалоиды, выделенные из ЛРС, обнаруживают на хроматограммах после проявления реактивом, дающим с алкалоидами окрашивание. В качестве проявителя, как правило, используют реактив Драгендорфа с добавлением аскорбиновой кислоты. При опрыскивании этим раствором хроматограмм алкалоиды на них проявляются в виде серо-бурых пятен. При проявлении хроматограмм спиртовыми растворами фосфорновольфрамовой (фосфорномолибденовой) кислоты либо обработкой парами йода (J2) алкалоиды на хроматограммах проявляются в виде бледно-желтых или бурых пятен.
Дата добавления: 2015-11-26; просмотров: 13712;
