Смещение химического равновесия. Принцип Ле-Шателье
Изменение условий (температура, давление, концентрация), при которых система находится в состоянии химического равновесия, вызывает нарушение равновесия в результате неодинакового изменения скоростей прямой и обратной реакции. С течением времени в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом или смещением положения равновесия.
Направление смещения положения химического равновесия в результате изменения внешних условиях определяется принципом Ле Шателье:
если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить температуру, давление, концентрацию), то равновесие смещается в сторону того процесса, который уменьшает это воздействие.
1. влияние температуры на состояние равновесия определяется знаком теплового эффекта:
при повышении температуры (нагревании) равновесие обратимой реакции смещается в сторону эндотермической реакции; при понижении температуры (охлаждении) равновесие обратимой реакции смещается в сторону экзотермической реакции.
Например, для реакции
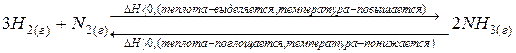
при повышении температуры равновесие смещается в сторону обратной реакции – эндотермической, протекающей с поглощением теплоты.
2. влияние давления на состояние равновесия определяется изменением объема или количества моль газообразных веществ в ходе реакции:
Например,
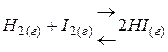 Þ
Þ 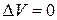 ,
т.к. ,
т.к. 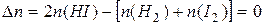 Таким образом, ни увеличение, ни уменьшение давления не смещают это равновесие.
Таким образом, ни увеличение, ни уменьшение давления не смещают это равновесие.
| 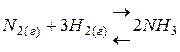 Þ
Þ 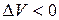 , т.к. , т.к.
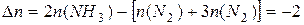 Таким образом, увеличение давления приведёт к смещению равновесия вправо, а уменьшение – влево.
Таким образом, увеличение давления приведёт к смещению равновесия вправо, а уменьшение – влево.
|
3. влияние концентрации реагирующих веществ на состояние равновесия:
при увеличении концентрации какого-либо вещества (путем его добавления) равновесие обратимой реакции смещается в сторону реакции, по которой это вещество реагирует, то есть расходуется. При уменьшении концентрации какого-либо вещества равновесие обратимой реакции смещается в сторону реакции, по которой это вещество образуется.
Например, для обратимой реакции 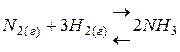 увеличение концентрации исходных веществ (
увеличение концентрации исходных веществ ( 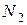 или
или 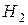 ) будет смещать равновесие вправо, т.е. в сторону продуктов реакции, а при уменьшении концентрации этих веществ – влево, т.е. в сторону образования исходных веществ. При увеличении концентрации продукта реакции (
) будет смещать равновесие вправо, т.е. в сторону продуктов реакции, а при уменьшении концентрации этих веществ – влево, т.е. в сторону образования исходных веществ. При увеличении концентрации продукта реакции ( 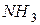 ) равновесие смещается влево, а при уменьшении концентрации – вправо.
) равновесие смещается влево, а при уменьшении концентрации – вправо.
Фазовое равновесие
Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава называются фазовыми.
Одним из наиболее общих законов гетерогенных равновесий (в том числе и фазовых) является правило фаз Гиббса (1876 г.):
в равновесной многофазной системе число степеней свободы (С) равно числу независимых компонентов системы (К) минус число фаз (Ф), плюс 2, где два – это число внешних факторов (p и T):
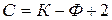 (48)
(48)
Компонент – химически однородное вещество, являющееся независимым составляющим веществом системы, может быть выделено из системы, и существовать изолировано любое время.
Например, для раствора хлорида калия (KCl) число компонентов равно 2.
В качестве независимых компонентов выбираются те вещества, наименьшее число которых достаточно для образования, как всей системы, так и любой её фазы.
Например, для образования равновесной системы из трех составляющих веществ 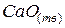 ,
, 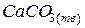 и
и 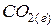 , при определении фаз достаточно взять два любых вещества, т.к. третье получается посредством реакции:
, при определении фаз достаточно взять два любых вещества, т.к. третье получается посредством реакции:
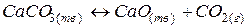 (49)
(49)
Следовательно, число независимых компонентов в данном случае равно двум.
Фаза – часть системы, отделенная от других её частей поверхностью раздела, переходя через которую свойства меняются скачкообразно.
Например, в равновесной системе, описанной уравнением (49), число фаз равно 2.
Степень свободы – число условий ( Т, р, С), которые можно менять произвольно в известных пределах, не меняя этим числа или вида фаз.
Гетерогенные многофазные системы могут быть классифицированы:
| 1. по числу степеней свободы: | 2. по числу компонентов: |
| · инвариантные (С=0); · моновариантные (С=1); · бивариантные (С=2); · поливариантные (С›2); | · однокомпонентные (К=1); · двухкомпонентные (К=2); · трехкомпонентные (К=3). |
Рассмотрим равновесную гетерогенную систему:
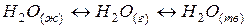 (50)
(50)
Для геометрического изображения равновесного состояния гетерогенных систем используют диаграммы состояния.
Диаграмма состояния, описывающая систему (50) представлена на рисунке 3.
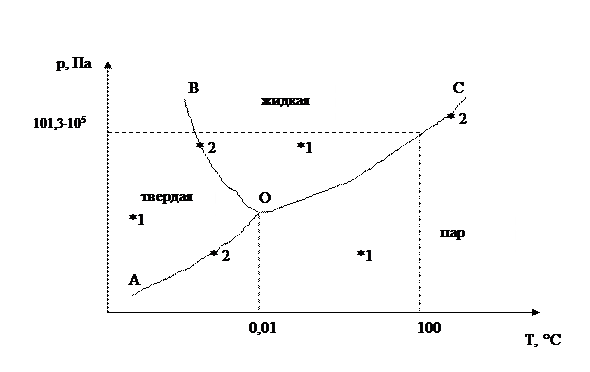
Рис. 3. Диаграмма состояния воды
Каждой фазе (жидкой, твердой, газообразной) отвечает определенное поле диаграммы, ограниченное от других фаз линией, характеризующей равновесие между данными двумя фазами ( 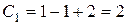 ).
).
Кривая ОА – отвечает равновесию в системе лед-пар (кривая возгонки);
Кривая ОС – равновесию в системе вода-пар (кривая испарения);
Кривая ОВ – равновесию в системе лед-вода (кривая плавления).
Следовательно, каждая кривая относится к двухфазной системе. Такие системы являются моновариантными ( 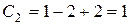 ).
).
Например, кривая ОС является кривой давления насыщенного пара над жидкой водой. Эта кривая показывает, что каждой температуре соответствует одно определенное давление пара, и, наоборот, каждому давлению соответствует определенная температура, при которой вода и пар находятся в равновесие. Так, при температуре 100˚С (рис. 3) обе фазы находятся в равновесии между собой только когда давление водяного пара равно 101,3∙105 Па. Изменение давления пара при той же температуре приведет к однофазной системе.
В точке О пересекаются все три кривые, характеризующие равновесие в указанных двухфазных системах. Эта точка отвечает равновесию между всеми тремя фазами: лед-вода-пар и называется тройной точкой.
Согласно правилу фаз (48) число степеней свободы в тройной точке равно нулю ( 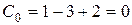 ). Равновесие в этой системе возможно только при строго определенных условиях (
). Равновесие в этой системе возможно только при строго определенных условиях ( 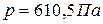 ,
, 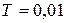 °С).
°С).
Правило фаз помогает анализировать сложные химические процессы, протекающие в гетерогенных системах.
Дата добавления: 2016-02-09; просмотров: 2414;
