Общие свойства растворов электролитов
Общая закономерность зависимости свойств разбавленных растворов от числа частиц растворенного вещества (понижение давления пара, величина осмотического давления, изменение температур, кристаллизация и кипение) оказалось справедливой только для растворов органических веществ в воде и для растворов в органических растворителях. Для водных растворов кислот, солей, оснований было обнаружено отклонение от законов Рауля и Вант-Гоффа.
Например, раствор, содержащий в 100г воды один моль хлорида натрия 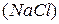 , замерзает не при температуре
, замерзает не при температуре 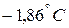 , а при
, а при 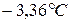 , т.е. примерно вдвое низшей. Значит, при растворении
, т.е. примерно вдвое низшей. Значит, при растворении 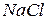 частиц в растворе стало в два раза больше, и поэтому они вызвали в два раза большее понижение температуры замерзания по сравнению с одномоляльным раствором неэлектролита.
частиц в растворе стало в два раза больше, и поэтому они вызвали в два раза большее понижение температуры замерзания по сравнению с одномоляльным раствором неэлектролита.
Наряду с этим, растворы, для которых характерны отклонения от законов разбавленных растворов, обладают значительной электрической проводимостью. Это можно объяснить наличием в растворе заряженных частиц.
Вещества, водные растворы или расплавы, которые проводят электрический ток, называются электролитами.
Распад электролитов на ионы под действием молекул растворителя называются электролитической диссоциацией.
Основные положения теорииэлектролитической диссоциацией были предложены шведским ученым С. Аррениусом (1887г.).
Согласно современным представлениям электролитическая диссоциация в растворе происходит в результате сложного физико-химического взаимодействия молекул электролита с полярными молекулами растворителя.
Например, процесс растворения в воде вещества 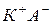 (вещество с ионной связью), может быть записан следующим образом:
(вещество с ионной связью), может быть записан следующим образом:
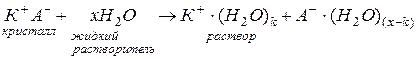
Ассоциации 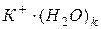 и
и 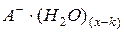 представляют собой гидратированные катионы и анионы.
представляют собой гидратированные катионы и анионы.
Количественными характеристиками электролитической диссоциации являются:
1) степень электролитической диссоциации 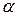 – это отношение числа молекул, распавшихся на ионы (
– это отношение числа молекул, распавшихся на ионы ( 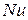 ), к общему числу молекул растворенного вещества в растворе (
), к общему числу молекул растворенного вещества в растворе ( 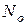 ):
):
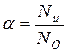 (65)
(65)
По степени диссоциации электролиты условно делят на: сильные ( 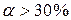 ) и слабые
) и слабые 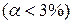 .
.
Степень диссоциации зависит:
а) от природы растворителя;
б) от температуры;
в) от концентрации раствора (например, концентрированная (безводная) уксусная кислота не проводит электрический ток, а разбавленная – проводит).
Применительно к сильным электролитам (их 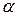 приближается к 1) понятие «степень диссоциации» носит условный характер.
приближается к 1) понятие «степень диссоциации» носит условный характер.
2) константа электролитической диссоциации 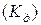 – это константа химического равновесия для процесса диссоциации электролита:
– это константа химического равновесия для процесса диссоциации электролита:
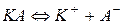
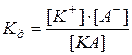 (66)
(66)
где 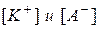 – равновесные концентрации ионов
– равновесные концентрации ионов 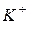 и
и 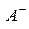 соответственно;
соответственно; 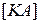 – концентрация непродиссоциировавших молекул
– концентрация непродиссоциировавших молекул 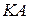 .
.
Константа диссоциации зависит:
а) от природы электролита;
б) от температуры.
Количественная зависимость между 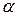 и
и 
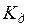 для растворов слабых электролитов описывается законом разведения Оствальда:
для растворов слабых электролитов описывается законом разведения Оствальда:
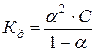 (67)
(67)
где 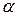 – степень диссоциации; С – начальная концентрация электролита;
– степень диссоциации; С – начальная концентрация электролита; 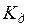 – константа диссоциации.
– константа диссоциации.
Т.е. с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается.
Находящиеся в растворе частицы-ионы и непродиссоциировавшие молекулы – оказывают одинаковое влияние на физические свойства растворов электролитов.
С учетом степени диссоциации к растворам электролитов можно применить законы Рауля и Вант-Гоффа, вводя поправочный коэффициент i (изотонический коэффициент – это коэффициент Вант-Гоффа).
Изотонический коэффициент (i) – это отношение суммы числа ионов и непродиссоциированных молекул электролитов к начальному числу молекул.
Изотонический коэффициент показывает, во сколько раз в растворе электролита возрастает общее число частиц по сравнению с числом молекул, введенных в раствор.
Изотонический коэффициент может быть выражен через степень электролитической диссоциации 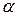 :
:
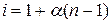
где N – число молекул электролита; 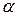 – степень диссоциации электролита; n – количество ионов, на которые распадается молекула электролита при диссоциации.
– степень диссоциации электролита; n – количество ионов, на которые распадается молекула электролита при диссоциации.
В связи с этим, законы Рауля и Вант-Гоффа для растворов электролитов будут иметь вид:
1) 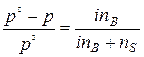 (68);
2) (68);
2) 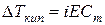 (69); (69);
| 3) 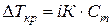 (70);
4) (70);
4) 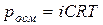 (71). (71).
|
Дата добавления: 2016-02-09; просмотров: 2538;
