Водородный показатель среды
Водные растворы различных соединений могут давать: кислую, щелочную или нейтральную реакцию. Реакция среды зависит от соотношения концентраций ионов 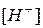 и
и 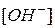 .
.
Поскольку абсолютные значения концентраций ионов 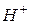 и
и 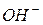 выражаются очень малыми числами, то для удобства введено понятие – водородный показатель среды.
выражаются очень малыми числами, то для удобства введено понятие – водородный показатель среды.
Водородный показатель среды ( 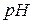 раствора) – отрицательный десятичный логарифм концентрации ионов
раствора) – отрицательный десятичный логарифм концентрации ионов 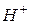 :
:
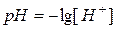 ,
, 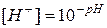 (75)
(75)
По аналогии введено понятие гидроксильного показателя (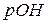 раствора)– отрицательный десятичный логарифм концентрации ионов
раствора)– отрицательный десятичный логарифм концентрации ионов 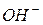 :
:
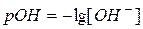 ,
, 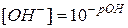 (76)
(76)
Используя формулы (75) и (76) выражение (74) можно записать:
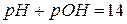 (77)
(77)
Следовательно, соотношения между реакцией среды, концентрацией ионов и значением водородного показателя следующие:
| среда | соотношения между концентрациями ионов | знак рН |
| нейтральная | 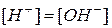
| 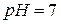
|
| кислая | 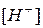 > > 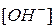 . .
| 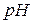 <7 <7
|
| щелочная | 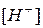 < < 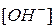 . .
| 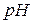 >7 >7
|
На практике для определения реакции среды часто использую индикаторы.
Кислотно-основные индикаторы – вещества, изменяющие свою окраску в зависимости от концентрации водородных ионов или гидроксид-ионов в растворе, т.е. в зависимости от рН среды.
Реакции гидролиза.
Гидролиз солей– реакция из обменного разложения водой, ведущая к образованию более слабого электролита, чем исходная соль (т.е. кислоты, основания и ионов 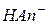 и
и 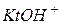 ):
):
Основные направления протекания реакций гидролиза представлены в таблице 3.
При наличии в растворе многозарядных ионов (2+, 3+, 2-, 3-) гидролиз идет ступенчато. При этом надо учитывать, что гидролиз при обычных условиях идет в достаточной мере только по первой ступени, а по второй, третьей ступеням – в очень незначительной степени.
Усилить гидролиз можно разбавлением раствора, нагреванием системы.
При появлении в растворе катиона с зарядом 2+, 3+, и аниона с зарядом 2-, 3-, может наступать взаимное усиление гидролиза при условии, что катион и анион вызывают гидролиз, т.е. смещают равновесие диссоциации воды. В этом случае гидролиз идет необратимо до конца.
Например, при сливании растворов 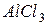 и
и 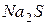 , происходит гидролиз каждой из указанных солей:
, происходит гидролиз каждой из указанных солей:
1) гидролиз 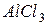 :
:
I ступень: 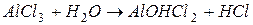
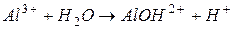
II ступень: 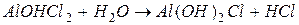
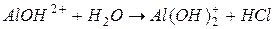
III ступень: 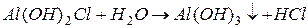
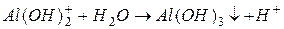
2) гидролиз 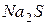 :
:
I ступень: 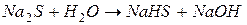
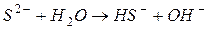
II ступень: 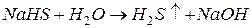
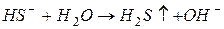
Таким образом, суммарно можно записать:
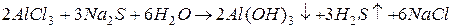
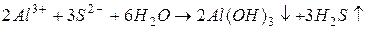
В данном случае гидроксильные групп 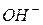 , образующиеся при гидролизе
, образующиеся при гидролизе 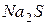 взаимодействуют с ионами
взаимодействуют с ионами 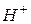 , образующимися при гидролизе
, образующимися при гидролизе 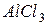 с образованием малодиссоциирующего вещества – воды. В итоге происходит разбавление раствора, и равновесие реакций гидролиза обеих солей смещается в сторону образования конечных продуктов, т.е. происходит усиление гидролиза.
с образованием малодиссоциирующего вещества – воды. В итоге происходит разбавление раствора, и равновесие реакций гидролиза обеих солей смещается в сторону образования конечных продуктов, т.е. происходит усиление гидролиза.
Таблица 3
Направления протекания реакций гидролиза
| тип соли | пример | уравнение реакции гидролиза | реакция среды |
| соль сильного основания и сильной кислоты | 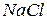
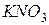
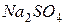
| гидролизу не подвергаются, так как при их взаимодействии с водой не могут быть получены слабые электролиты.
В системе 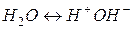 не нарушается не нарушается
| нейтральная
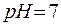
|
| соль сильного основания и слабой кислоты | 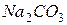
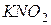
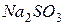
| гидролиз 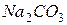 :
I ступень: :
I ступень: 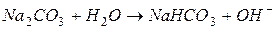
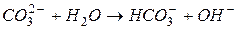 II ступень:
II ступень: 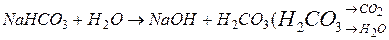
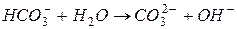
| в растворе остается избыток гидроксид-ионов,
среда щелочная
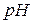 >7 >7
|
| соль слабого основания и сильной кислоты | 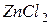
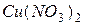
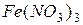
| гидролиз 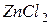 :
I ступень: :
I ступень: 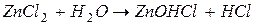
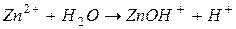 II ступень:
II ступень: 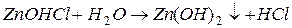
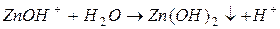
| в растворе остается избыток катионов водорода, среда кислая
 <7 <7
|
| соль слабого основания и слабой кислоты | 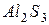
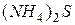
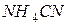
| гидролиз 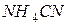 : :
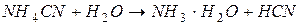 ; ;
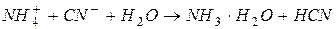
| реакция среды условно нейтральная* |
*при строгом определении реакции среды для этого вида солей, необходимо сравнить численные значения констант диссоциации кислоты и основания, образующихся в результате гидролиза.
Дата добавления: 2016-02-09; просмотров: 1304;
