Ионное произведение воды
Вода является одним из наиболее распространенных в природе веществ. Молекула воды имеет угловое строение (рисунок 5).
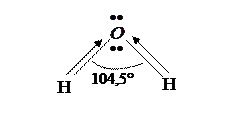
Рис. 5. Строение молекулы воды
В молекуле воды связь между атомами водорода и кислорода является полярной. При указанном расположении атомов в молекуле это приводит к асимметрии в распределении электрических зарядов, к ее полярности (дипольный момент 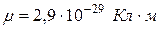 ).
).
Высокая полярность молекулы – одна из важнейших причин высокой активности воды при многих химических взаимодействиях. Полярность является причиной электролитической диссоциации в воде солей, кислот, оснований, с ней связана растворимость электролитов в воде, гидролизуемость соединений и т.д.
Способность молекул воды к образованию водородных и донорно-акцепторных связей оказывает сильное влияние на состояние и свойства растворов.
Упрощенное уравнение, отражающее процесс электролитической диссоциации воды:
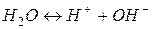
Запишем выражение для константы ионизации воды:
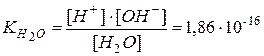 (73)
(73)
где 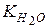 – константа электролитической диссоциации воды.
– константа электролитической диссоциации воды.
Пусть 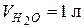 , тогда молярная концентрация составит
, тогда молярная концентрация составит 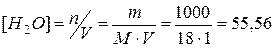 (моль/л) (т.к. при н.у.
(моль/л) (т.к. при н.у. 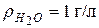 , т.е.
, т.е. 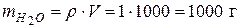 ).
).
Следовательно, 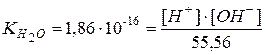
Þ 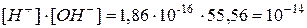 .
.
Согласно полученного уравнения для воды и водных растворов различных веществ при определенной температуре произведение концентрации ионов водорода и гидроксид-ионов есть величина постоянная, которая называется ионным произведением воды ( 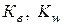 ).
).
Таким образом, при 25 °С 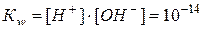 (74),
(74),
а 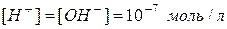 .
.
Величина ионного произведения воды возрастает с повышением температуры, так как при этом увеличивается степень электролитической диссоциации воды, и возрастают концентрации протонов водорода и гидроксид-ионов.
Дата добавления: 2016-02-09; просмотров: 1141;
