Общие свойства растворов неэлектролитов
Растворы имеют ряд свойств, которые при данной температуре зависят только от числа частиц растворенного вещества. Эти свойства называют коллигативными: чем больше частиц в растворе, тем сильнее выражены коллигативные свойства.
К коллигативным свойствам относятся:
1. понижение давления насыщенного пара растворителя над раствором;
2. повышение температуры кипения раствора;
3. понижение температуры замерзания (кристаллизации) раствора;
4. осмотическое давление.
Рассмотрим эти свойства в отдельности.
1) давление пара растворов:
Над любой жидкостью (растворителям или раствором) устанавливается определённое давление пара, насыщающее пространство.
Это давление характеризует состояние равновесия между жидкой фазой (раствором) и находящимися над нею паром:

Смещение этого равновесия зависит от термодинамических условий и подчиняется принципу Ле Шателье. Поэтому, если в жидкость внесено практически нелетучее вещество, то число молекул растворителя, испаряющихся с поверхности жидкости, сокращается, что вызывает уменьшение давления пара над раствором, и равновесие устанавливается при более низком давлении, чем для чистого раствора.
Согласно закону Рауля
Относительное понижение парциального давления насыщенного пара растворителя над разбавленным раствором неэлектролита равно мольной доле растворённого вещества:
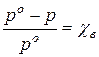 (61)
(61)
где 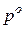 – давление насыщенного пара чистого растворителя при данной температуре;
– давление насыщенного пара чистого растворителя при данной температуре;
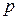 – давление насыщенного пара растворителя над раствором;
– давление насыщенного пара растворителя над раствором;
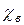 – мольная доля растворённого вещества.
– мольная доля растворённого вещества.
2) температура кипения и кристаллизации разбавленных растворов.
Фазовые превращения при образовании растворов могут быть описаны температурами кипения и кристаллизации, которые вследствие понижения давления пара над раствором, отличаются от соответствующих значений для чистых растворителей и зависят от концентрации растворённых веществ.
Любая жидкость кипит, когда давление её насыщенного пара достигнет величины внешнего давления.
Температура, при которой давление насыщенного пара жидкости равно нормальному давлению (760мм. рт. ст. или 101325 Па), называется нормальной температурой кипения.
Согласно закону Рауля давление насыщенного пара растворителя над раствором ниже давления насыщенного пара над чистым растворителем при той же температуре (рисунок 4).
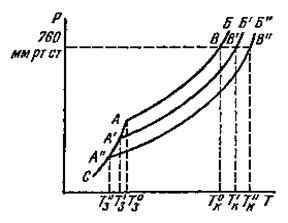
| Рис. 4. Диаграмма зависимости давления пара над водой и раствором от температуры |
Следовательно, при температуре кипения чистого растворителя, давление насыщенного пара над раствором нелетучего вещества не достигает нормального давления, и раствор кипит при более высокой температуре.
Любая жидкость кристаллизуется, когда давление её насыщенного пара равно давлению насыщенного пара соответствующих кристаллов. При температуре кристаллизации чистого растворителя давление насыщенного пара растворителя над раствором не достигает давления пара кристаллов, и из раствора чистый растворитель кристаллизуется при более низкой температуре (рисунок 4).
Для сильно разбавленных растворов в различных растворителях Раулем было установлено:
понижение температуры кристаллизации или повышение температуры кипения разбавленных растворов неэлектролитов прямо пропорционально моляльной концентрации растворённого вещества:
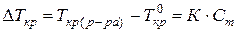 (62)
(62)
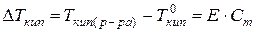 (63)
(63)
где 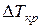 – понижение температуры кристаллизации;
– понижение температуры кристаллизации;
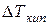 – повышение температуры кипения;
– повышение температуры кипения;
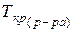 и
и 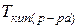 – температуры кристаллизации и кипения раствора, соответственно;
– температуры кристаллизации и кипения раствора, соответственно; 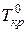 и
и 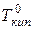 – температуры кристаллизации и кипения чистого растворителя, соответственно;
– температуры кристаллизации и кипения чистого растворителя, соответственно;
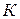 – криоскопическая константа – показывает понижение температуры замерзания раствора, содержащего 1 моль вещества в 1 кг растворителя (т.е.
– криоскопическая константа – показывает понижение температуры замерзания раствора, содержащего 1 моль вещества в 1 кг растворителя (т.е. 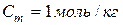 );
); 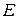 – эбуллиоскопическая константа – показывает повышение температуры кипения раствора, содержащего 1 моль вещества в 1 кг растворителя;
– эбуллиоскопическая константа – показывает повышение температуры кипения раствора, содержащего 1 моль вещества в 1 кг растворителя;
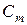 – моляльность раствора, моль/кг.
– моляльность раствора, моль/кг.
3) осмотическое давление.
При соприкосновении раствора и чистого растворителя, которые разделены полупроницаемой (т.е. проницаемой только для молекул растворителя) мембраной, растворитель проникает в раствор, преодолевая избыточное давление до достижения его равновесного значения – осмотического давления.
Осмотическое давление не зависит от природы растворителя и растворенного вещества.
Осмотическое давление может быть определено по закону Вант-Гоффа:
Осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора:
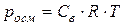 (64)
(64)
где 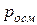 – осмотическое давление, Па;
– осмотическое давление, Па; 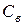 – молярная концентрация,
– молярная концентрация, 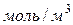 ;
; 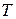 – температура, К;
– температура, К; 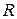 – универсальная газовая постоянная,
– универсальная газовая постоянная, 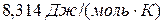 .
.
Дата добавления: 2016-02-09; просмотров: 2800;
