Химическое равновесие. Все химические реакции по направленности делят на:
Все химические реакции по направленности делят на:
1. необратимые – протекают до полного израсходования одного из веществ, и не способны менять свое направление при изменении температуры и давления,
например, 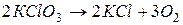 ,
, 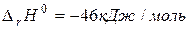
2. обратимые – протекают одновременно при данных условиях, как в прямом, так и в обратном направлении,
например, 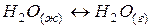 ,
, 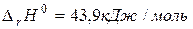
Большинство химических реакций являются обратимыми.
Рассмотрим процесс образования 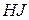 (при 450 °С, когда
(при 450 °С, когда 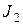 находится в состоянии пара):
находится в состоянии пара):
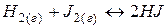 .
.
Вначале, при смешивании исходных веществ скорость прямой реакции ( 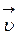 ) велика, а обратной (
) велика, а обратной ( 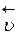 ) – равна нулю, со временем, концентрации исходных веществ убывают (скорость
) – равна нулю, со временем, концентрации исходных веществ убывают (скорость 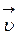 уменьшается), тогда как скорость обратной реакции (
уменьшается), тогда как скорость обратной реакции ( 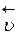 ) – возрастает (наблюдается увеличение концентрации продуктов реакции).
) – возрастает (наблюдается увеличение концентрации продуктов реакции).
В определенный момент времени ( 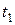 ) в системе наступает подвижное равновесие, при котором скорости прямой и обратной реакции равны, т.е.
) в системе наступает подвижное равновесие, при котором скорости прямой и обратной реакции равны, т.е. 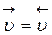 (рис.2).
(рис.2).
Т.к. химическое равновесие обусловливается не прекращением реакции, а равенством скоростей двух противоположных процессов, то оно является равновесным динамическим (подвижным).
Состояние химического равновесия количественно характеризуют величиной константы равновесия, которая выводится на основе закона действия масс.
Выведем математическое выражение для константы равновесия гомогенного и гетерогенного процессов:

Рис. 2. Изменение концентрации реагирующих веществ 1 – исходных и 2 – конечных с течением времени
1. гомогенный процесс:
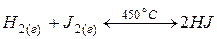
Запишем выражение  и
и  :
: 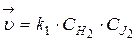 ;
; 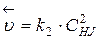 .
.
Из равенства скоростей прямой и обратной реакций в момент равновесия, можно записать:
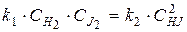 Þ
Þ 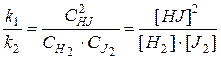 (35)
(35)
где [HJ], [H2], [J2] – равновесные концентрации реагентов.
2. гетерогенный процесс:
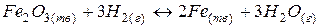
Запишем выражение 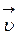 и
и 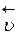 (концентрация твердого вещества будет практически постоянной величиной и поэтому не входит в выражение константы равновесия).
(концентрация твердого вещества будет практически постоянной величиной и поэтому не входит в выражение константы равновесия).
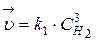 и
и 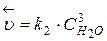
Из равенства скоростей прямой и обратной реакций в момент равновесия, можно записать
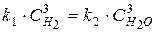 Þ
Þ 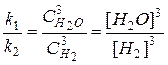 (36)
(36)
где [H2О], [H2] – равновесные концентрации реагентов.
Соотношение констант скоростей 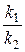 при постоянной температуре является также константой:
при постоянной температуре является также константой:
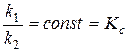 .
.
Таким образом, для реакции в общем виде:
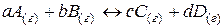 (37)
(37)
константа равновесия записывается следующим образом:
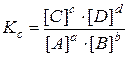 (38)
(38)
где [C], [D], [A], [B] – равновесные концентрации реагентов,
показатели степеней при концентрациях равны стехиометрическим коэффициентам.
Приведенное уравнение (38) является математическим выражением закона действия масс применительно к обратимым реакциям:
при постоянной температуре отношение произведения равновесных концентраций (или парциальных давлений) конечных веществ к произведению равновесных концентраций (или парциальных давлений) исходных веществ есть величина, которую принято называть константой равновесия.
Химическое равновесие между газообразными веществами при небольших давлениях удобнее выражать через парциальные давления ( 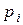 ), участвующих в реакции (37) веществ:
), участвующих в реакции (37) веществ:
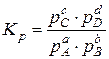 (39)
(39)
где рС, pD, pA, pB – равновесные парциальные давления реагентов,
показатели степеней при парциальных давлениях равны стехиометрическим коэффициентам.
Значение константы равновесия:
| зависит | не зависит |
| § от природы реагирующих веществ § температуры | § от присутствия катализатора |
Установим связь между Кр и Кс.
Согласно закону Дальтона, общее давление газовой смеси, состоящей из идеальных газов, равно сумме парциальных давлений каждого газа смеси:
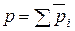 (40)
(40)
Для каждого газа такой смеси справедливо уравнение Менделеева – Клапейрона:
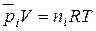 (41)
(41)
Поскольку 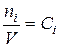 , следовательно,
, следовательно, 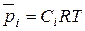 (42)
(42)
Для химического взаимодействия
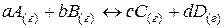
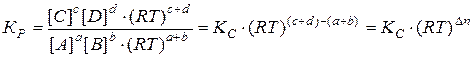 (43)
(43)
где 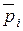 – равновесные парциальные давления;
– равновесные парциальные давления;
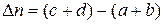 (44) – изменение числа моль газообразных веществ в реакции.
(44) – изменение числа моль газообразных веществ в реакции.
Константа равновесия определяет глубину протекания процесса к моменту достижения равновесного состояния. Чем больше эта величина, тем больше степень превращения реагентов в продукты.
Дата добавления: 2016-02-09; просмотров: 973;
