Химическая кинетика
Одним из основных параметров химических процессов, осуществляемых в промышленности, является скорость, с которой эти процессы протекают. Иногда способ химической переработки сырья может быть простым, термодинамически принципиально возможным, однако время, необходимое для получения продукта, оказывается весьма значительным. Поэтому такой процесс не будет рентабельным и его нельзя применить в промышленности.
Химическая кинетика – раздел химии, в котором изучаются скорости и механизмы химических реакций.
В зависимости от агрегатного состояния веществ, реакции бывают гомогенными и гетерогенными.
Гомогенная реакция – это реакция, протекающая с участием веществ, находящихся в одинаковом агрегатном состоянии.
Например: 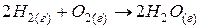
Гетерогенная реакция – это реакция, протекающая с участием веществ, находящихся в разных агрегатных состояниях или же любая реакция, протекающая на поверхности твердого катализатора.
Например: 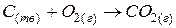 ;
; 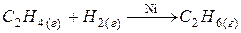 .
.
Если реакция протекает в гомогенной системе, то она идет во всем объеме этой системы, если в гетерогенной – то только на поверхности раздела фаз, образующих данную систему.
В связи с этим скорость гомогенной реакции и скорость гетерогенной реакции определяются различно.
Скорость химической реакции определяется изменением количества вещества в единицу времени в единице объема системы (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
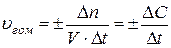 (26)
(26)
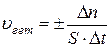 (27)
(27)
где 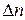 – изменение числа моль исходного вещества или продукта реакции за интервал времени
– изменение числа моль исходного вещества или продукта реакции за интервал времени 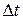 ; V – объем гомогенной системы; S – площадь поверхности раздела фаз для гетерогенной системы; ∆C – изменение концентрации
; V – объем гомогенной системы; S – площадь поверхности раздела фаз для гетерогенной системы; ∆C – изменение концентрации 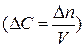 .
.
Знак «–» перед дробью относится к концентрации исходных веществ, т.к. в этом случае 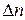 или ∆С < 0 (исходные вещества расходуются в ходе реакции); знак «+» – к концентрации продуктов реакции, т.к. их количество увеличивается в ходе реакции (
или ∆С < 0 (исходные вещества расходуются в ходе реакции); знак «+» – к концентрации продуктов реакции, т.к. их количество увеличивается в ходе реакции ( 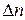 или ∆С > 0).
или ∆С > 0).
Различают два вида скоростей:
1) средняя скорость реакции ( 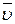 ) – это скорость реакции за данный промежуток времени ∆t:
) – это скорость реакции за данный промежуток времени ∆t:
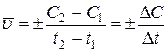 (28)
(28)
где 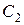 и
и 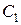 - молярная концентрациия любого участника реакции в моменты времени
- молярная концентрациия любого участника реакции в моменты времени 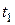 и
и 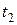 соответственно.
соответственно.
2) истинная (мгновенная) скорость – это бесконечно масое изменение концентрации за бесконечно малый отрезок времени:
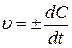 (29)
(29)
Скорость химических реакций зависит от многих факторов: концентрации реагентов; температуры; катализаторов; давления; степени измельчения (для твердых веществ) и др. Рассмотрим влияние некоторых факторов.
Дата добавления: 2016-02-09; просмотров: 710;
