Термохимические расчеты
Раздел химии, изучающий тепловые эффекты реакций, называется термохимией.
Термохимические уравнения – химические уравнения, записанные с указанием теплового эффекта реакции и агрегатного состояния веществ.
В общем случае,
в изолированном процессе, теплоту (Q), выделяемую или поглощаемую в ходе реакции называют тепловым эффектом реакции.
Тепловой эффект обычно приводится для 1 моль вещества и измеряется в Дж или кДж.
Реакции, протекающие с выделением теплоты, называются экзотермическими DН<0.
Реакции, протекающие с поглощением теплоты, называют эндотермическими DН>0.
Следует отметить, что коэффициенты термохимических уравнений могут иметь и дробные величины.
Например, термохимическое уравнение получения 1 моль H2O можно записать следующим образом:
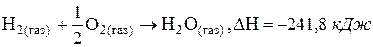
Закон Гесса.
Для расчетов тепловых эффектов различных процессов используется закон, установленный русским ученым Гессом (1840г):
Тепловой эффект реакции не зависит от пути протекания процесса, а определяется лишь начальным и конечным состоянием веществ, участвующих в реакции.
Иными словами, тепловой эффект любой реакции не зависит от того, образовалось ли соединение сразу из исходных веществ или оно получилось в результате ряда последовательных реакций.
Рассмотрим это на примере.
Превращение графита в оксид углерода (IV) может происходить двумя путями:
1) непосредственное сгорание графита:
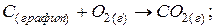
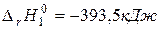
2) по отдельным стадиям:
а) 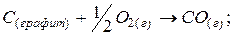
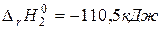
б) 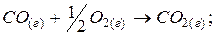
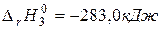
Если сложить уравнения (а) и (б)
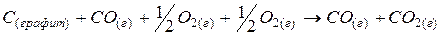 ,то получим
,то получим 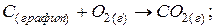 и
и 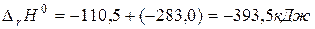 .
.
Рассмотренные превращения можно проиллюстрировать схемой:
Начальное состояние
| 
| Конечное состояние
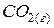
| |||||
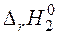
| 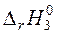
| ||||||
промежуточное
состояние
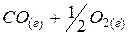
| |||||||
Согласно закону Гесса: 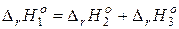 .
.
Закон Гесса справедлив для любых процессов, происходящих с изменением энергии.
При расчетах тепловых эффектов химических реакций на основе закона Гесса используются стандартные теплоты образования и сгорания веществ:
1. Тепловой эффект химической реакции равен разности сумм стандартных теплот образования продуктов реакции и исходных веществ:
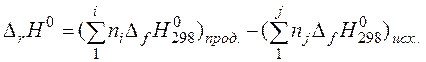 (18)
(18)
где 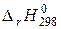 – тепловой эффект реакции;
– тепловой эффект реакции;
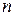 – коэффициенты в уравнении реакции;
– коэффициенты в уравнении реакции;
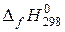 – стандартная теплота образования вещества.
– стандартная теплота образования вещества.
Стандартная теплота образования вещества – тепловой эффект реакции образования 1 моль вещества из простых веществ.
Для реакции в общем виде:
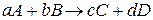
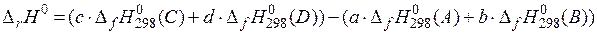
2. Тепловой эффект химической реакции равен разности сумм стандартных теплот сгорания исходных веществ и продуктов реакции:
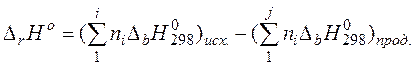 (19)
(19)
где 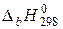 – стандартная теплота сгорания вещества.
– стандартная теплота сгорания вещества.
Стандартная теплота сгорания вещества – тепловой эффект реакции окисления кислородом 1 моль данного соединения до высших оксидов.
Дата добавления: 2016-02-09; просмотров: 1476;
