ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Химия – наука, изучающая свойства и превращения веществ, сопровождающиеся изменением их состава и строения.
Процесс превращения одних веществ в другие называется химической реакцией.
Теоретическую основу современной химии составляет атомно-молекулярное учение, согласно которому:
атом – наименьшая частица химического элемента, являющаяся носителем его свойств;
химический элемент – вид атомов с одинаковым зарядом ядра.
Наиболее типичной формой существования вещества является молекула:
молекула – наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его основные химические свойства.
Раздел химии, который рассматривает количественные (массовые, объемные) соотношения между реагирующими веществами называется стехиометрией.
Основные (фундаментальные) законы химии приведены в таблице 1.
Таблица 1
Основные законы химии
| № п/п | Название закона | Формулировка закона | пояснения |
| Закон сохранения массы (М.В. Ломоносов, 1748г., А. Лавуазье, 1773г.) | Масса веществ, вступающих в химическую реакцию равна массе веществ, образующихся в результате реакции | Закон верен лишь в практическом смысле: т.к. любое химическое взаимодействие сопровождается изменением энергии системы, а масса и энергия эквивалентны, то изменяется и масса системы; однако вследствие относительно незначительных энергетических эффектов реакций, изменения массы исключительно малы и не могут быть измерены современными инструментальными методами. | |
| Закон постоянства состава | Всякое чистое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав. | Закон применим только к соединениям с молекулярной структурой; соединения с немолекулярной структурой часто имеют переменный состав, не отвечающий целочисленным стехиометрическим соотношениям, что во многом объясняется условиями получения таких веществ. | |
| Продолжение таблицы 1 | |||
| № п/п | Название закона | Формулировка закона | пояснения |
| Закон эквивалентов | Вещества вступают в химические реакции в относительных количествах, пропорциональных их молярным массам эквивалентов: | ||
Для реакции: 
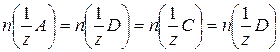 (1) (1)
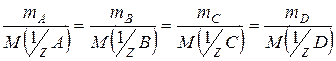 (2)
где (2)
где 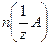 –химическое количество вещества эквивалентов соединения А; –химическое количество вещества эквивалентов соединения А;
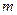 – масса вещества; – масса вещества; 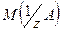 –молярная масса эквивалентов вещества А; –молярная масса эквивалентов вещества А;
| |||
| Эквивалент – некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-то другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях. Химический эквивалент вещества или соединения – такое его количество, которое взаимодействует с 1 моль атомов водорода или замещает это же количество атомов водорода в химических соединениях. | |||
| Продолжение таблицы 1 | |||
| № п/п | Название закона | Формулировка закона | пояснения |
Расчет молярной массы эквивалентов 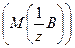 веществ:
1. простое вещество: веществ:
1. простое вещество:  (3); где (3); где 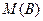 – молярная масса вещества, – молярная масса вещества, 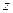 – валентность данного элемента,
2. сложное вещество:
а) основание: – валентность данного элемента,
2. сложное вещество:
а) основание:  (4); где (4); где 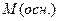 – молярная масса основания, – молярная масса основания, 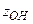 – число гидроксильных групп;
б) кислота: – число гидроксильных групп;
б) кислота: 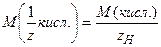 (5); где (5); где 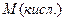 – молярная масса кислоты, – молярная масса кислоты,
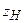 – число атомов водорода, способных замещаться на металл;
в) соль: – число атомов водорода, способных замещаться на металл;
в) соль: 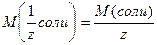 (6); где (6); где 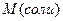 – молярная масса соли, – молярная масса соли,
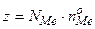 (7): (7): 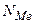 и и  – число атомов металла, и его степень окисления соответственно;
г) оксид: – число атомов металла, и его степень окисления соответственно;
г) оксид:  (8), где (8), где 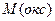 – молярная масса оксида, – молярная масса оксида,
 (9): (9): 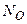 и и  – число атомов кислорода, и его степень окисления соответственно. – число атомов кислорода, и его степень окисления соответственно.
| |||
| Продолжение таблицы 1 | |||
| № п/п | Название закона | Формулировка закона | пояснения |
| Газовые законы: | |||
| а) закон объемных отношений Гей-Люссака | При неизменных температуре и давлении объемы вступающих в реакцию газов относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа | ||
| б) закон Авогадро(1811) Следствия из закона Авогадро: | В равных объемах любых газов при одинаковых условиях (температура и давление) содержится равное число молекул | ||
1. при одинаковых условиях 1 моль любого газа занимает одинаковый объем;
2. при нормальных условиях (н.у.) – давление 101325 Па, температура – 273,15 К– 1 моль различных газов занимает объем 22,4 л (  );
3. отношение масс равных объемов различных газов равно отношению их молярных масс: );
3. отношение масс равных объемов различных газов равно отношению их молярных масс:
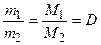 (10), где (10), где  и и 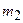 – массы первого и второго газов; – массы первого и второго газов;  и и 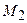 – молярные массы первого и второго газов; – молярные массы первого и второго газов;
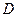 – относительная плотность первого газа по второму. – относительная плотность первого газа по второму.
| Например:
Плотность кислорода по:
· водороду 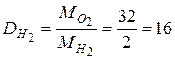 · воздуху
· воздуху 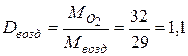
| ||
| Продолжение таблицы 1 | |||
| № п/п | Название закона | Формулировка закона | пояснения |
| Объединенный газовый закон | 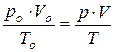 (11),
где (11),
где 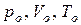 – давление, объем и температура при н.у., соответственно; – давление, объем и температура при н.у., соответственно;
 – давление, объем и температура данного количества газообразного вещества при других условиях.
Если в данный закон подставить: – давление, объем и температура данного количества газообразного вещества при других условиях.
Если в данный закон подставить:
 , , 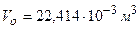 , ,
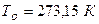 , то , то
 , где , где 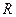 – универсальная газовая постоянная
Þ – универсальная газовая постоянная
Þ  (12) –
уравнение состояния идеального газа (уравнение Менделеева-Клапейрона). (12) –
уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).
| Данный закон является объединением двух газовых законов:
· закон Бойля-Мариотта – при постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится, т.е. 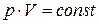 · закон Гей-Люссака – при постоянном давлении изменение объема газа прямо пропорционально температуре, т.е.
· закон Гей-Люссака – при постоянном давлении изменение объема газа прямо пропорционально температуре, т.е. 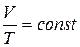
|
Рассмотрим пример расчета молярной массы эквивалентов:
1. для индивидуальных веществ:
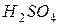 :
: 
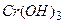 :
: 
 :
: 
 :
: 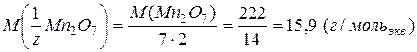
2. для кислотно-основного взаимодействия:
·  ,
, 
· 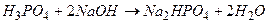 ,
,
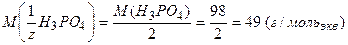
· 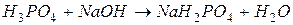 ,
, 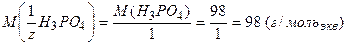
Дата добавления: 2016-02-09; просмотров: 764;
