Первое начало термодинамики. Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика
Обмен энергией между изучаемой системой и внешней средой описывают законы, которые изучает термодинамика. Применение законов термодинамики в химии позволяет решить вопрос о принципиальной возможности различных процессов, условиях их осуществления, определить степень превращения реагирующих веществ в химических реакциях и оценить их энергетику.
Система – это тело или группа тел, связанных между собой и мысленно или физически выделенных из окружающей среды.
Внешняя среда – вещества, окружающие систему.
Обмен энергией между системой и внешней средой может осуществляться в различных формах: тепловая, механическая, электрическая энергия, энергия излучения могут превращаться друг в друга. В превращениях, происходящих в ходе химических реакций, участвуют, как правило, тепловая энергия и механическая, или работа.
При любом химическом процессе соблюдается закон сохранения энергии. Первое начало термодинамики – это частный случай закона сохранения и превращения энергии, в применении к процессам, сопровождающимся выделением или поглощением теплоты:
Теплота ( 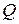 ), сообщенная системе, идет на изменение ее внутренней энергии (
), сообщенная системе, идет на изменение ее внутренней энергии ( 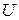 ) и на совершение работы (
) и на совершение работы ( 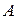 ):
):
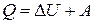 (13)
(13)
где 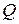 – теплота;
– теплота; 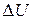 – изменение внутренней энергии;
– изменение внутренней энергии; 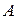 – работа против сил внешнего давления.
– работа против сил внешнего давления.
Внутренняя энергия ( 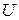 ) системы – это общий запас энергии системы, включающий все виды энергии молекул, атомов, электронов и внутриядерную энергию(кроме потенциальной и кинетической энергии системы в целом).
) системы – это общий запас энергии системы, включающий все виды энергии молекул, атомов, электронов и внутриядерную энергию(кроме потенциальной и кинетической энергии системы в целом).
Внутренняя энергия “  ” является функцией состояния системы, и ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода:
” является функцией состояния системы, и ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода:  , где
, где 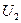 и
и  – внутренняя энергия системы в состоянии 2 и 1 соответственно.
– внутренняя энергия системы в состоянии 2 и 1 соответственно.
В отличие от внутренней энергии, теплота и работа являются функциями процесса. Функция процесса зависит от вида процесса (изохорный, изобарный и т.д.), с помощью которого система переходит от начального состояния к конечному.
Работа– это работа против всех сил, действующих на систему (внешнее давление, силы поверхностного натяжения и др.).
Состояние системы определяется совокупностью её физических и химических свойств, и характеризуется термодинамическими параметрами системы (например: температура, объём, состав системы). Состояние системы аналитически можно представить в виде уравнения состояния 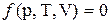 .
.
Многие химические реакции протекают либо при постоянном объеме ( 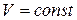 , процесс изохорный), либо при постоянном давлении (
, процесс изохорный), либо при постоянном давлении ( 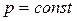 , процесс изобарный).
, процесс изобарный).
В ходе химической реакции совершается в основном работа против сил внешнего давления, которая зависит от объема системы:
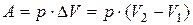 , где V2 и V1 – объемы газообразных продуктов реакции и исходных веществ соответственно.
, где V2 и V1 – объемы газообразных продуктов реакции и исходных веществ соответственно.
Проанализируем уравнение (13): 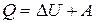
1) для изохорного процесса ( 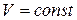 ):
): 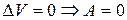 .
.
Следовательно, уравнение (13) приобретает вид 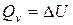 (14)
(14)
т.е. тепловой эффект реакции при постоянном объеме и температуре T соответствует изменению внутренней энергии системы в ходе реакции.
К реакциям, протекающим изохорно, можно отнести: реакции в автоклаве, между твердыми и жидкими веществами без выделения газов и др.
2) для изобарного процесса ( 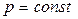 ):
):
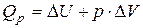 (15)
(15)
С учетом начального 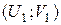 и конечного
и конечного 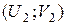 состояний системы, получим:
состояний системы, получим:
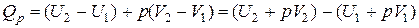
Функция  обозначается
обозначается 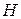 , называется энтальпией (теплосодержанием). Энтальпия является функцией состояния, имеет размерность энергии
, называется энтальпией (теплосодержанием). Энтальпия является функцией состояния, имеет размерность энергии
Таким образом, 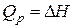 (16)
(16)
т.е. тепловой эффект реакции при постоянном давлении и температуре 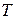 соответствует изменению энтальпии системы в ходе реакции.
соответствует изменению энтальпии системы в ходе реакции.
Исходя из выражений (13) – (16), имеем:
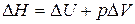
или 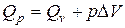
Для перехода из одного состояния в другое уравнение 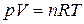 запишется
запишется 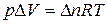 . Следовательно, для реакции между идеальными газами
. Следовательно, для реакции между идеальными газами
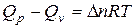 (17)
(17)
где 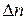 – разность между количеством образовавшихся газообразных продуктов и количеством газообразных исходных веществ.
– разность между количеством образовавшихся газообразных продуктов и количеством газообразных исходных веществ.
Изменение внутренней энергии и энтальпии принято относить к веществам, находящимся в стандартных состояниях. Стандартным состоянием вещества при данной температуре называют его состояние в виде чистого вещества при давлении (в случае газов – при парциальном давлении данного газа), равном нормальному атмосферному давлению (101,325 кПа).
Изменения 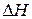 и
и 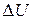 , отнесенные к стандартным условиям, называют стандартными и обозначают:
, отнесенные к стандартным условиям, называют стандартными и обозначают: 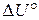 – стандартное изменение внутренней энергии в ходе реакции,
– стандартное изменение внутренней энергии в ходе реакции, 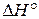 – стандартное изменение энтальпии при химической реакции.
– стандартное изменение энтальпии при химической реакции.
Дата добавления: 2016-02-09; просмотров: 843;
