Зависимость скорости реакции от концентрации.
Зависимость скорости химической реакции от концентрации определяется законом действия масс (Гульдберг и Вааге, 1867 г.):
в изотермическом процессе скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ (в степенях с показателями, равными стехиометрическим коэффициентам в уравнении реакции).
Для реакции в общем виде 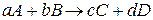 её скорость, согласно закону действия масс, выражается соотношением:
её скорость, согласно закону действия масс, выражается соотношением:
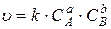 (30)
(30)
где 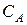 и
и 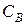 молярные концентрации реагирующих веществ;
молярные концентрации реагирующих веществ;
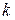 – константа скорости данной реакции;
– константа скорости данной реакции;
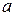 и
и 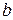 – стехиометрические коэффициенты уравнения реакции.
– стехиометрические коэффициенты уравнения реакции.
Следует иметь в виду, что концентрация газообразных веществ изменяется пропорционально давлению: чем выше давление, тем меньше объем, а значит больше концентрация.
Константа скорости реакции имеет физический смысл скорости реакции, когда концентрации реагирующих веществ равны единице.
Величина константы скорости 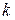 зависит:
зависит:
1) от природы реагирующих веществ;
2) от температуры;
3) от присутствия катализатора
но не зависит от концентрации реагирующих веществ.
Для гетерогенной реакции, например: 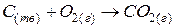
Выражение для скорости реакции будет иметь вид:
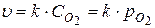 , где С – концентрация; р – давление.
, где С – концентрация; р – давление.
При этом концентрация веществ в твердом состоянии (в данном случае – углерода) будет практически постоянной величиной, поэтому на скорость реакции влиять не будет, и поэтому в выражение скорости реакции не входит.
Дата добавления: 2016-02-09; просмотров: 880;
