Энтропия системы. II начало термодинамики
Для определения направления химического процесса недостаточно сведений об изменении внутренней энергии или энтальпии, т.к. система с одной стороны стремится к упорядочению и уменьшению внутренней энергии; с другой – к беспорядку и увеличению внутренней энергии. Первое стремление растёт с понижением температуры, а второе – с повышением.
Весь запас внутренней энергии системы можно разделить на две части:
1) свободную энергию – часть внутренней энергии, которая может быть полезно использована (например, превращена в работу);
2) связанную энергию – часть внутренней энергии, которая в виде теплоты теряется в окружающей среде и не может быть полезно использована (это те потери, которые неизбежно сопровождают любой реальный процесс).
Связанную энергию представляют как произведение абсолютной температуры на некоторую функцию, которая получила название энтропии.
Под энтропией S понимают меру, оценивающую степень беспорядка в системе. Энтропия часто понимается как мера рассеивания энергии. Таким образом
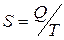 (20)
(20)
Размерность энергии: 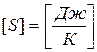 .
.
Согласно II началу термодинамики:
1) энтропия связана с термодинамической вероятностью реализации данного состояния вещества соотношением (уравнение Больцмана):
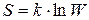 (21)
(21)
где S – энергия системы; k – постоянная Больцмана ( 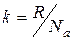 , R – универсальная газовая постоянная,
, R – универсальная газовая постоянная, 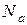 – число Авогадро); W – термодинамическая вероятность системы, т.е. число возможных микросостояний, соответствующее данному макросостоянию вещества.
– число Авогадро); W – термодинамическая вероятность системы, т.е. число возможных микросостояний, соответствующее данному макросостоянию вещества.
2) в изолированных системах изменение энтропии служит критерием, определяющим направление процесса:
Энтропия самопроизвольно протекающего процесса в изолированной системе возрастает, т.е. 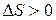
В случае закрытых систем энтропия в ходе процесса может, как увеличиваться, так и уменьшаться.
Процессы, для которых:
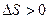 1) расширение газов
2) растворение кристаллических
веществ
3) фазовые превращения
1) расширение газов
2) растворение кристаллических
веществ
3) фазовые превращения
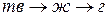
| 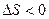 1) сжигание газов
конденсация и кристаллизация веществ
1) сжигание газов
конденсация и кристаллизация веществ
|
Поскольку энтропия есть функция состояния системы, то для химической реакции в стандартных условиях:
Изменение энтропии реакции 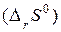 равно разности сумм стандартных энтропий продуктов реакции и исходных веществ:
равно разности сумм стандартных энтропий продуктов реакции и исходных веществ:
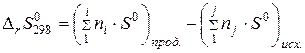 (22)
(22)
где 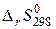 – стандартное изменение энтропии реакции,
– стандартное изменение энтропии реакции,
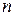 – коэффициенты в уравнении реакции,
– коэффициенты в уравнении реакции,
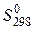 – стандартная энтропия вещества.
– стандартная энтропия вещества.
Дата добавления: 2016-02-09; просмотров: 646;
