Ионные реакции в растворах
Ионные реакции – реакции в растворах электролитов, при которых не происходит изменения зарядов ионов, входящих в соединения.
Ионные реакции могут быть обратимыми и необратимыми:
1. обратимые реакции ионного обмена протекают с участием сильных электролитов:
например, 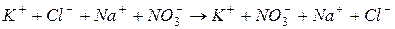
Это означает, что реакция практически не происходит, и если выпарить раствор досуха, то твердый остаток будет представлять собой смесь четырех солей. Преимущественное выделение при упаривании той или иной соли определяется ее растворимостью.
2. необратимые реакции ионного обмена протекают в сторону образования:
а) осадков (малорастворимых веществ):
например, 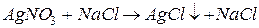
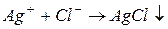
В насыщенном растворе малорастворимого сильного электролита устанавливается равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе, в рассматриваемом примере это равновесие: 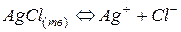 .
.
Константа равновесия этого процесса имеет вид:
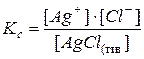
При постоянной температуре 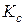 и
и 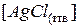 будут иметь постоянные значения, т.к. растворимость электролита
будут иметь постоянные значения, т.к. растворимость электролита 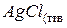 в воде постоянна и часть его, содержащаяся в растворе, полностью диссоциирована (вследствие малой концентрации раствора). Поэтому произведение двух постоянных величин будет также величиной постоянной, которая называется произведением растворимости (ПР):
в воде постоянна и часть его, содержащаяся в растворе, полностью диссоциирована (вследствие малой концентрации раствора). Поэтому произведение двух постоянных величин будет также величиной постоянной, которая называется произведением растворимости (ПР):
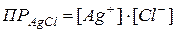 .
.
Для реакции в общем виде 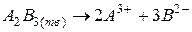 , выражение для произведения растворимости будет иметь вид:
, выражение для произведения растворимости будет иметь вид:
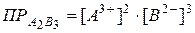 (72)
(72)
Таким образом, произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита при данной температуре есть величина постоянная (табличная), называемая произведением растворимости.
Произведение растворимости позволяет регулировать процессы образования и растворения труднорастворимых веществ. Например, для 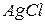 в зависимости от величины произведения концентраций ионов
в зависимости от величины произведения концентраций ионов 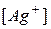 и
и 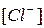 , и сравнив ее с табличным значением произведения растворимости (
, и сравнив ее с табличным значением произведения растворимости ( 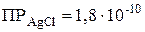 ), можно сделать следующие выводы:
), можно сделать следующие выводы:
§ если 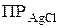 >
> 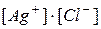 – то раствор ненасыщен, осадок не образуется;
– то раствор ненасыщен, осадок не образуется;
§ если 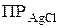 <
< 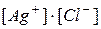 – раствор насыщен, осадок образуется до тех пор, пока
– раствор насыщен, осадок образуется до тех пор, пока 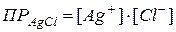 .
.
б) газообразных (легколетучих) веществ:
например, 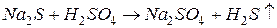
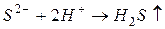
Если эту реакцию проводить до конца в открытом сосуде, то 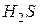 удаляется из сферы реакции, т.е. не может участвовать в обратном процессе, и данная реакция идет практически до конца.
удаляется из сферы реакции, т.е. не может участвовать в обратном процессе, и данная реакция идет практически до конца.
в) слабых электролитов (малодиссоциирующих соединений):
например,
§ образование воды: 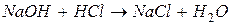
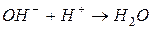
§ образование слабого основания:
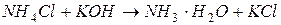
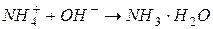
§ образование слабой кислоты:
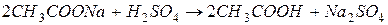
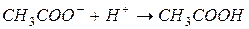
При образовании малодиссоциирующих соединений происходит связывание ионов реагирующих веществ, и растворы становятся слабыми проводниками электрического тока.
г) комплексных ионов:
например, 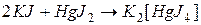
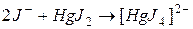
Дата добавления: 2016-02-09; просмотров: 2851;
