Понятие о стандартных электродных потенциалах.
Обычно определяют относительные электродные потенциалы. С этой целью измеряют ЭДС гальванического элемента, составленного из стандартного (нормального) водородного электрода, потенциал которого принимают за 0, и электродом исследуемого металла (рисунок 7).
Стандартный водородный электрод представляет собой платиновую пластину, покрытую слоем мелкораздробленной платины, насыщенную водородом при давлении 0,1 МПа и погруженную в 1н раствор серной кислоты (рисунок 8). Насыщенная водородом платиновая пластинка ведет себя как водородный электрод, у поверхности которого устанавливается равновесие: 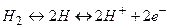 .
.
Стандартный электродный потенциал металла – разность потенциалов между металлом, погруженным в раствор своей соли с концентрацией ионов металла 1 моль/л, и стандартным водородным электродом (мы будем обозначать ее буквой j).
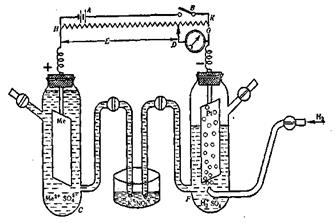 Рис. 7. Схема определения электродного потенциала
Рис. 7. Схема определения электродного потенциала
| 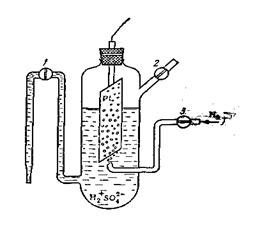 Рис. 8. Водородный электрод
Рис. 8. Водородный электрод
|
Ряд электродных потенциалов называют также рядом напряжений (“вытеснительный ряд” Н.Н. Бекетова):
Каждый левее стоящий металл вытесняет каждый правее стоящий металл из раствора его соли. Металл с меньшим потенциалом всегда будет окисляться (анодом), с большим – восстанавливаться (катодом).
Уравнение Нернста.
Зависимость электродного потенциала от концентрации одноименных ионов в растворе описывается уравнением НЕРНСТА:
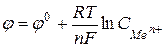 (78),
(78),
или 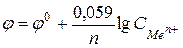 (79) (при Т=298 К)
(79) (при Т=298 К)
где 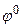 – стандартный (нормальный) электродный потенциал металла, В;
– стандартный (нормальный) электродный потенциал металла, В;
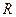 – универсальная газовая постоянная, 8,314 Дж/(моль×К);
– универсальная газовая постоянная, 8,314 Дж/(моль×К);
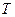 – температура, К;
– температура, К; 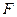 – постоянная Фарадея, 96500Кл/моль;
– постоянная Фарадея, 96500Кл/моль;
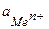 – активность ионов металла в растворе, моль/л;
– активность ионов металла в растворе, моль/л;
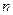 – число электронов, принятых или отданных в ходе реакции.
– число электронов, принятых или отданных в ходе реакции.
Дата добавления: 2016-02-09; просмотров: 1896;
