Количественные законы электролиза
Были установлены М. Фарадеем и носят названия законов Фарадея.
Первый закон Фарадея: массы веществ, претерпевших изменения на электродах прямо пропорциональны электрохимическим эквивалентам веществ.
Электрохимическим эквивалентом называется масса вещества, изменяющаяся при прохождении 1 Кл электричества.
Второй закон Фарадея: масса вещества, претерпевшая изменения на электродах, прямо пропорциональна количеству прошедшего электричества Q.
Объединяя первый и второй законы Фарадея, получим, что
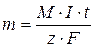 (80),
(80),
где М – молярная масса вещества, I – сила тока, t – время электролиза, z – число электронов, принимающих участие в полуреакции, F – постоянная Фарадея.
Для газообразных веществ можно записать аналогичное выражение
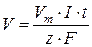 (81)
(81)
В качестве примера количественных расчетов по уравнению Фарадея определим какая масса меди выделяется на катоде при электролизе раствора CuCl2 током 6 А в течение 4 ч. Запишем полуреакцию восстановления меди.
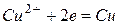 (z = 2)
(z = 2)
Подставим данные в уравнение Фарадея
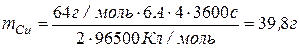 .
.
Реально масса или объем вещества будет меньше – это связано с тем, что помимо основной реакции могут протекать побочные, также требующие расхода тока. Для учета побочных реакций вводят дополнительную величину – выход по току (h). Выход по току равен отношению практической массы (объема) вещества к массе (объему) вещества, рассчитанного по закону Фарадея.
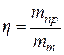 (82),
(82),
поскольку 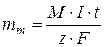 , то
, то
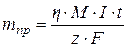 (83).
(83).
Коррозия металлов
Коррозией называется самопроизвольный процесс разрушения металлов под действием факторов окружающей среды, сопровождающийся выделением энергии и рассеиванием вещества.
Металлы играют важную роль в народном хозяйстве. Коррозия ежегодно разрушает до 10 % производимого железа в мире. Поэтому важным моментом при изучении свойств конструкционных материалов является рассмотрение вопросов устойчивости различных металлов, а также приемов защиты металлов от коррозии.
Дата добавления: 2016-02-09; просмотров: 1867;
