Гальванические элементы.
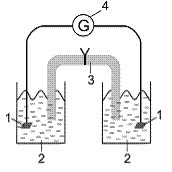 Рис. 9. Элемент Якоби-Даниэля. 1 – металлические электроды; 2 – растворы солей; 3 – солевой мостик; 4 – гальванометр
Рис. 9. Элемент Якоби-Даниэля. 1 – металлические электроды; 2 – растворы солей; 3 – солевой мостик; 4 – гальванометр
|
Гальванический элемент – это устройство, в котором химическая энергия непосредственно превращается в электрическую.
Устройство и принцип работы гальванических элементов рассмотрим на примере элемента Якоби-Даниэля. Элемент Якоби-Даниэля состоит из двух металлических электродов (медного и цинкового) погруженных в растворы солей этих металлов (рисунок 9). Потенциал медного электрода можно рассчитать по формуле 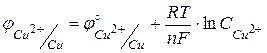 , аналогично, потенциал цинкового электрода будет равен
, аналогично, потенциал цинкового электрода будет равен 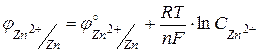 . Если концентрации ионов Cu2+ и Zn2+ в растворах равны между собой и равны 1 моль/л, то такой элемент называется стандартным.
. Если концентрации ионов Cu2+ и Zn2+ в растворах равны между собой и равны 1 моль/л, то такой элемент называется стандартным.
Для нахождения ЭДС гальванического элемента от потенциала катода необходимо вычесть потенциал анода 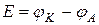 . В данном элементе катодом является медный электрод, а анодом – цинковый.
. В данном элементе катодом является медный электрод, а анодом – цинковый.
Тогда 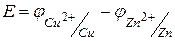 .
.
Подставим значения потенциалов электродов.
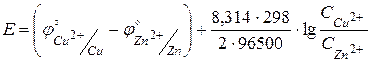 .
.
Значения стандартных окислительно-восстановительных потенциалов для меди и цинка равны соответственно 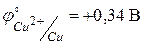 ,
, 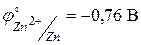 . Тогда ЭДС стандартного элемента Якоби-Даниэля будет равна
. Тогда ЭДС стандартного элемента Якоби-Даниэля будет равна 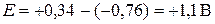 .
.
При работе гальванического элемента на катоде будет протекать реакция 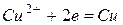 , а на аноде
, а на аноде 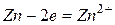 . Электроны во внешней цепи будут перемещаться от цинкового электрода к медному.
. Электроны во внешней цепи будут перемещаться от цинкового электрода к медному.
Суммарная реакция, протекающая в данном элементе
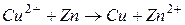
Схематическая запись элемента Якоби-Даниэля

При работе элемента концентрация ионов цинка будет увеличиваться, а концентрация ионов меди – уменьшаться. Поэтому при работе элемента его ЭДС со временем уменьшается. В подобных гальванических элементах можно использовать и другие металлические электроды.
Электролиз
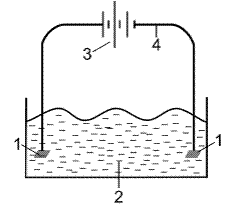 Рис. 10. Схема прибора для электролиза. 1 – электроды, 2 ‑ электролит, 3 – источник тока, 4 – внешняя цепь
Рис. 10. Схема прибора для электролиза. 1 – электроды, 2 ‑ электролит, 3 – источник тока, 4 – внешняя цепь
|
Электролиз – это окислительно-восстановительная реакция, протекающая на электродах под действием электрического тока.
Общая схема установки для проведения электролиза изображена на рисунке 10. Она состоит из двух электродов, погруженных в раствор электролита и внешнего источника тока.
При проведении электролиза катод заряжен отрицательно, а анод – положительно. Рассмотрим электролиз водных растворов различных веществ.
Возможные варианты катодных процессов (восстановления) если катион:
1. это 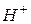 – в этом случае катодный процесс записывается следующим образом:
– в этом случае катодный процесс записывается следующим образом: 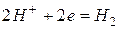
2. это ион металла, находящегося в электрохимическом ряду напряжений после водорода: 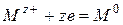
3. это ион металла, находящегося в электрохимическом ряду напряжений до алюминия включительно: 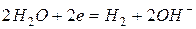
4. это ион металла, находящегося в электрохимическом ряду напряжений между Al и Н. Для этих ионов одновременно протекают реакции как их восстановления, так и реакция восстановления воды с выделением Н2. Но в уравнение реакции записывают только восстановление металла.
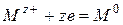
Возможные варианты анодных процессов (окисления) если анион:
1. это гидроксид ион 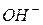 , то анодный процесс записывается следующим образом:
, то анодный процесс записывается следующим образом: 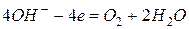
2. это бескислородсодержащие анионы 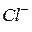 ,
, 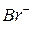 ,
, 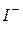 (
( 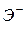 ), то уравнение:
), то уравнение: 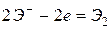
3. это анионы кислородсодержащих кислот (  ,
, 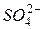 ,
, 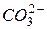 ) и
) и 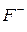 , то уравнение:
, то уравнение: 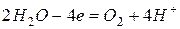
Рассмотрим примеры записей уравнений реакций электролиза для различных веществ.
1. Электролиз водного раствора серной кислоты
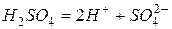
Катодный процесс 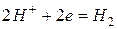
Анодный процесс 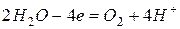
Суммарно 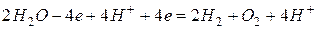
После сокращения 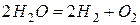
2. Электролиз водного раствора хлорида меди (II)
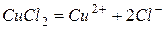
Катодный процесс 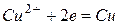
Анодный процесс 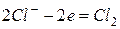
Суммарно 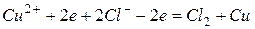
После сокращения 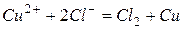 или
или 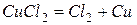
3. Электролиз водного раствора нитрата серебра
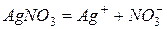
Катодный процесс 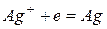
Анодный процесс 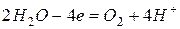
Суммарно 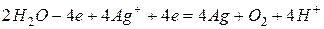
После сокращения 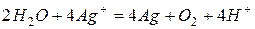 или
или 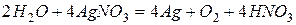
Рассмотренные примеры электродных процессов справедливы для инертных электродов, т.е. для электродов, не принимающих участие в электрохимическом процессе. Если материал электрода изменяется в процессе электролиза, то его называют активным электродом. Рассмотрим процесс электролиза водного раствора CuSO4 с активным анодом (медным). Отличительной особенностью процесса электролиза с активным анодом является то, что происходит окисление материала электрода, а не компонентов раствора.
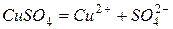
Катодный процесс 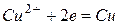
Анодный процесс 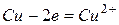
Суммарно 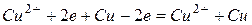
После сокращения 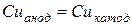
Таким образом, при электролизе водного раствора CuSO4 с медными электродами происходит перенос меди с анода на катод, а состав электролита не изменяется.
Дата добавления: 2016-02-09; просмотров: 1081;
