Гальванические элементы и их ЭДС
Из двух электродов может быть составлена электрохимическая цепь — гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Перенос заряда через границу раздела фаз (электрический ток) в такой системе осуществляется за счет электрохимической реакции, протекающей самопроизвольно. Электрод, на котором происходит электровосстановление, называется катодом, а электрод, на котором происходит электроокисление, называется анодом.
Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.
Правильно разомкнутая электрохимическая цепь, на концах которой можно измерить электрическую разность потенциалов, всегда должна заканчиваться одинаковыми по своему химическому составу металлами. Обычно это достигается простым подключением к металлам М1 и М2 медных проводов. Включение между двумя металлическими проводниками третьего металлического проводника, согласно закону Вольта, не изменяет разности потенциалов на концах цепи.
Электрохимическая цепь является равновесной при условии, что электрохимическое равновесие наблюдается на каждой фазовой границе, а разность потенциалов на концах цепи Е скомпенсирована разностью потенциалов от внешнего источника тока.
При схематической записи электрохимической цепи:
1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов;
2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).
В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают.
Cогласно правилу записи электродной реакции, окисленная форма вещества и электроны записываются слева. Суммарная реакция, протекающая в элементе, является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то – в обратном направлении.
Учитывая, что на катоде происходим электровосстановление, а на аноде – электроокисление, то в гальваническом элементе (при протекании самопроизвольных процессов) катод будет более электроположительным электродом, а анод более электроотрицательным. Если же элемент подключить к внешнему источнику тока и вызвать вынужденные электрохимические процессы (электролиз), то катодом будет более электроотрицательным электродом, а анод – более электроположительным. Во избежание путаницы термины катод и анод чаще употребляют при рассмотрении электролиза, а при рассмотрении гальванических элементов белее употребляют термины «плюс» и «минус» для обозначения катода и анода, соответственно.
Рассмотрим в качестве примера три случая.
1. Оба электрода имеют общий раствор:
Pt, H2(г) | HCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e  Ag + Cl–(aq);
Ag + Cl–(aq);
(2) 2H+(aq) + 2 e  H2(г).
H2(г).
Суммарная реакция, протекающая в элементе
AgCl + 0.5H2(г)  Ag + HCl(aq).
Ag + HCl(aq).
Если ЭДС этого элемента положительна, то суммарная реакция будет протекать в прямом направлении, правый электрод будет более положительным – плюсом (катодом), а левый электрод – более отрицательным – минусом (анодом).
2. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен);
Cd | Cd(NO3)2(aq) ¦ NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e–  Ag + Cl–(aq);
Ag + Cl–(aq);
(2) Cd2+(aq) + 2 e  Cd.
Cd.
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2Cd  Ag + 1/2Cd2+(aq) + Cl–(aq).
Ag + 1/2Cd2+(aq) + Cl–(aq).
3. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен).
Pt | H2(г) | HCl(aq) || NaCl(aq) | AgCl | Ag
На электродах протекают реакции:
(1) AgCl + e  Ag + Cl–(aq);
Ag + Cl–(aq);
(2) 2H+(aq) + 2 e–  H2(г).
H2(г).
Суммарная реакция, формально протекающая в элементе
AgCl + 1/2H2(г)  Ag + H+(aq) + Cl–(aq).
Ag + H+(aq) + Cl–(aq).
Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E.
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент (рис.4).
Разность потенциалов на концах этой цепи складывается из трех гальвани-потенциалов:
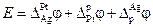 . (3.32)
. (3.32)
В общем виде в формировании ЭДС гальванического элемента участвуют не только скачки потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов – так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов – диффузионный потенциал.
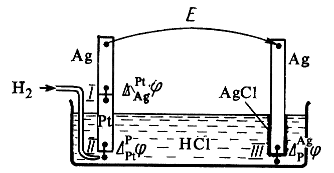
Рис. 4. Гальванический элемент, составленный из водородного
и хлоридсеребряного электродов.
Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO3).
Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения гальвани-потенциалов на границе раздела фаз в гальваническом элементе, значение Эдс гальванического элемента вычисляют как разность двух условных электродных потенциалов:
E = Eп – Eл , (3.33)
где Eп– потенциал правого электрода, Eл – потенциал левого.
Химические цепи
Гальванические элементы первого типа – химические цепи представляют собой элементы, составленные из электродов, на которых протекают различные электрохимические реакции.
В основе работы всякого электрохимического элемента лежат самопроизвольные окислительно-восстановительные реакции, протекающие раздельно: на более отрицательном электроде (аноде) — окисление, на более положительном (катоде) — восстановление.
Соединение электродов внешним проводником приводит к появлению в цепи электрического тока. Например, элемент Даниэля — Якоби составлен из двух электродов первого рода цинкового и медного. Последовательность соединения их изображают схемой:
Cu | Zn | ZnSO4(aq) ¦ CuSO4(aq) | Cu.
(1) Cu2+(aq) + 2 e–  Cu;
Cu;
(2) Zn2+(aq) + 2 e–  Zn.
Zn.
Суммарная реакция, протекающая в элементе
Zn + Cu2+(aq)  Cu + Zn2+(aq).
Cu + Zn2+(aq).
ЭДС этого элемента
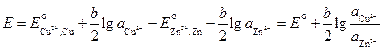 , (3.34)
, (3.34)
где 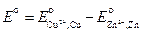 .
.
Различают химические цепи с двумя и с одним электролитом. К электрохимическим элементам с двумя электролитами относятся рассмотренный выше элемент Даниэля — Якоби.
Химические цепи с одним электролитом могут быть двух видов.
В цепях первого вида один электрод обратим относительно катиона, другой — относительно аниона. Например, элемент
Cd | CdCl2(aq) | AgCl | Ag
Он используется для определения среднего коэффициента активности электролита CdCl2. Рассчитаем ЭДС этого элемента.
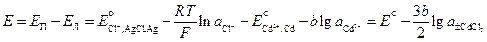 , (3.35)
, (3.35)
где 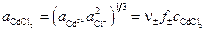 – средняя активность раствора CdCl2.
– средняя активность раствора CdCl2.
В гальванических элементах второго вида (с одним электролитом) оба электрода обратимы относительно одного из ионов. Примером может служить элемент
Hg | Hg2Cl2 | KCl (aq) | Cl2(г) | Pt
Выражение для ЭДС этого элемента равно:
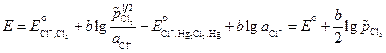 . (3.36)
. (3.36)
Если создать условия, при которых 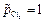 , то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
, то ЭДС этого элемента будет равна стандартной ЭДС. Такого типа гальванические элементы используются для точного определения стандартной электродвижущей силы (Еº) элемента.
Дата добавления: 2016-01-09; просмотров: 3323;
