Электроды второго рода
Электродом первого рода называется металл (A), погруженный в раствор, содержащий насыщенное соединение (малорастворимое или комплексное) иона этого металла (A+) и избытка аниона (B–). Таким образом, электрод второго рода обратим относительно аниона (т. е. его потенциал зависит от концентрации этого аниона).
B–(р-р) | AB(т) | A(т)
AB(т) + e–  A(т) + B–(р-р).
A(т) + B–(р-р).
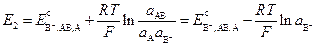 . (3.23)
. (3.23)
Примеры,
Cl–(aq) | AgCl | Ag — хлоридсеребряный электрод;
Cl–(aq) | Hg2Cl2 | Hg — каломельный электрод.
Примером может служить хлоридсеребряный электрод, состоящий из серебряной проволоки или пластины, покрытой осадком хлорида серебра, и опущенный в раствор, насыщенный относительно хлорида серебра и содержащий избыток хлорид-иона. Для этого часто используют соли хорошо растворимых хлоридов (KCl, NaCl).
На электроде протекает окислительно-восстановительная реакция
AgCl(т) + e–  Ag(т) + Cl-(aq).
Ag(т) + Cl-(aq).
По уравнению Нернста, потенциал электрода равен:
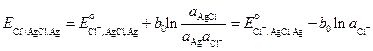 . (3.24)
. (3.24)
Деление на электроды первого и второго рода, строго говоря, является условным. Любой электрод второго рода можно рассматривать как электрод первого рода, обратимый относительно катиона.
Рассмотрим, например, хлоридсеребряный электрод Cl–(aq) | AgCl | Ag как электрод первого рода. Протекающая на электроде реакция будет иметь вид:
Ag+ + e–  Ag.
Ag.
Потенциал этого электрода, как электрода первого рода
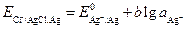 . (3.25)
. (3.25)
Активность ионов серебра в растворе, содержащем ионы хлора, можно рассчитать из произведения растворимости (Ks) соли AgCl
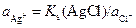 .
.
Поэтому потенциал хлоридсеребряного электрода равен:
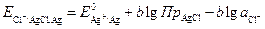 (3.26)
(3.26)
Сравнивая полученные выражения, можно найти связь равновесных стандартных потенциалов электродов первого и второго рода, имеющих в основе один и тот же металл.
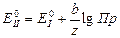 . (3.27)
. (3.27)
К электродам второго рода относятся и оксидныеэлектроды, состоящие из металла, покрытого оксидом этого металла, и находящемся в растворе, содержащем гидроксид-ионы. Например, ртутно-оксидный электрод второго рода: OH- | Hg2O, Hg, который обратим относительно гидроксид-ионов. Электродная реакция
Hg2O + Н2О + 2 e–  2 Нg + 2 OH-.
2 Нg + 2 OH-.
Потенциал электрода
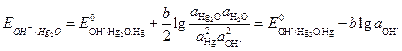 . (3.28)
. (3.28)
Электроды второго рода часто используются в лабораторной практике как электроды сравнения (относительно электродов сравнения устанавливается или измеряется потенциалы других электродов), это связано с надежностью их работы, хорошей воспроизводимостью потенциала и простотой изготовления. При использовании различных электродов сравнения электродные потенциалы выражают либо в шкале принятого электрода сравнения, либо (когда это возможно) переводят измеренное значение в водородную шкалу.
Газовые электроды
Газовые электроды выделяют по признаку того, что один из участников окислительно-восстановительной пары находится в газовой фазе.
Примеры,
H+(aq) | H2(г) | Pt(т) — водородный электрод;
Cl–(aq) | Cl2(г) | Pt(т) — хлорный электрод.
Примером газового электрода является, например, водородный электрод H+½ H2 ,Pt, на котором протекает реакция
H+ +e = 1/2H2.
Электродный потенциал водородного электрода зависит от относительного давления газа водорода:
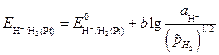 . (3.29)
. (3.29)
В водородной шкале потенциалов значение 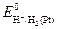 принято равным нулю.
принято равным нулю.
На газовом хлорном электроде Cl-½Cl2, Pt протекает реакция:
Cl2 + e= Cl- - е- = 1/2 Сl2 ,
и электродный потенциал равен:
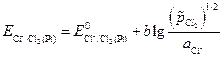 . (3.30)
. (3.30)
Как видно из приведенных выше электрохимических реакций, протекающих на электродах первого рода, одной из форм (окисленной или восстановленной) является простое соединение (атомы металла, неметалла или молекулы газа), а другой формой – ионы этого соединения.
Дата добавления: 2016-01-09; просмотров: 2728;
