Электроды нулевого рода (окислительно-восстановительные электроды)
Окислитель и восстановитель, как правило, находятся в растворе, а фаза проводника первого рода выполнена из инертного материала (например, Pt), которая выступает в качестве контакта и не участвует в электрохимической реакции.
Ox(р-р), Red(р-р) | Pt
Ox(р-р) + z e–  Red(р-р),
Red(р-р),
Рассмотрим несколько примеров. Окислительно-восстановительный электрод может состоять из простой окислительно-восстановительной пары. Например,
Fe2+(aq), Fe3+(aq) | Pt.
В таком электроде протекает реакция простой перезарядки иона
Fe3+(aq) + e–  Fe2+(aq),
Fe2+(aq),
Тогда потенциал этого электрода
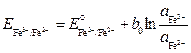 . (3.18)
. (3.18)
В более сложном случае в окислительно-восстановительной реакции могут принимать участие вещества или ионы не изменяющие в ходе реакции своей степени окисления. Например, хингидронный электрод
C6H4O2, C6H4(OH)2, H+(aq) | Pt.
На электроде протекает реакция:
C6H4O2 + 2H+(aq) + 2 e–  C6H4(OH)2.
C6H4(OH)2.
Потенциал этого электрода
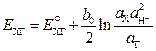 . (3.19)
. (3.19)
Потенциал электрода будет зависеть не только от концентрации хинона (Х) и гидрохинона (Г) в растворе, но и от активности иона водорода, т.е. кислотности среды. Такие электроды могут применяться для измерения pH раствора.
Дата добавления: 2016-01-09; просмотров: 1418;
