Глава 3. Равновесные электродные процессы. Электродные потенциалы и ЭДС гальванических элементов. Потенциометрия
3.1.Электрохимический потенциал и равновесие на границе электрод/раствор. Условный электродный потенциал. Уравнение Нернста
В химической термодинамике для характеристики свойств систем, не содержащих заряженные частицы, и в которых изменение состава происходит в результате протекания химических реакций или фазовых превращений используют фундаментальное уравнение Гиббса, выраженное через характеристическую функцию 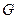 :
:
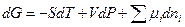 , (3.1)
, (3.1)
где 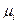 - химический потенциал
- химический потенциал 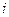 -го реагента, а
-го реагента, а 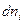 - бесконечно малое изменение количества этого реагента.
- бесконечно малое изменение количества этого реагента.
При рассмотрении явлений в гетерогенных системах, необходимо учитывать к какой фазе относятся величины 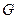 ,
, 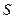 ,
, 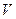 ,
, 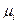 ,
, 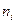 . Принадлежность к определенной фазе указывается верхним индексом, например -
. Принадлежность к определенной фазе указывается верхним индексом, например - 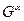 ,
, 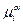 . Условием равновесия в гетерофазной системе при постоянных температуре и давлении (Т и Р – const) является равенство химических потенциалов
. Условием равновесия в гетерофазной системе при постоянных температуре и давлении (Т и Р – const) является равенство химических потенциалов 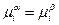 , где
, где 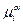 и
и 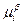 - химические потенциалы нейтрального вещества в двух сосуществующих фазах.
- химические потенциалы нейтрального вещества в двух сосуществующих фазах.
Если компонент 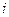 представляет собой заряженную частицу, то его состояние зависит еще и от величины электрического поля. При перемещении заряженных частиц в фазе в электрическом поле, перенос массы
представляет собой заряженную частицу, то его состояние зависит еще и от величины электрического поля. При перемещении заряженных частиц в фазе в электрическом поле, перенос массы 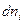 компонента
компонента 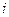 связан с переносом заряда
связан с переносом заряда 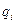 . Фундаментальное уравнение Гиббса в этом случае должно иметь вид:
. Фундаментальное уравнение Гиббса в этом случае должно иметь вид:
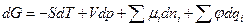 , (3.2)
, (3.2)
где - 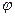 - внутренний потенциал какой либо фазы, то есть внутренний потенциал той части системы, в которой находится данная частица.
- внутренний потенциал какой либо фазы, то есть внутренний потенциал той части системы, в которой находится данная частица.
Внутренним потенциалом 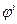 называется работа переноса единичного отрицательного воображаемого заряда из бесконечно удаленной точки А, находящейся в вакууме, в точку В, находящуюся внутри проводящей фазы
называется работа переноса единичного отрицательного воображаемого заряда из бесконечно удаленной точки А, находящейся в вакууме, в точку В, находящуюся внутри проводящей фазы 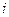 .
.
Термин «воображаемый» предполагает, что этот единичный заряд реагирует только на внешнее электрическое поле и не взаимодействует со средой.
Так как 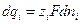 , где
, где 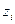 - заряд
- заряд 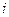 -го иона с учетом знака заряда;
-го иона с учетом знака заряда; 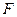 - постоянная Фарадея,
- постоянная Фарадея, 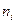 - число молей i-го вещества, то после преобразований получаем:
- число молей i-го вещества, то после преобразований получаем:
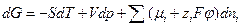 . (3.3)
. (3.3)
Все производные энергии Гиббса по обобщенным координатам имеют смысл обобщенных сил. Поэтому 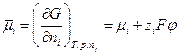 - это обобщенная сила в явлениях переноса заряженных частиц в электрическом поле. По аналогии с химическим потенциалом, для электрохимических систем, величина
- это обобщенная сила в явлениях переноса заряженных частиц в электрическом поле. По аналогии с химическим потенциалом, для электрохимических систем, величина
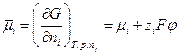 называется электрохимическим потенциалом.
называется электрохимическим потенциалом.
При перемещении одного моля реальных заряженных частиц 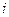 (с зарядом
(с зарядом 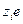 ) из бесконечности в вакууме вглубь проводящей фазы (например, фазы
) из бесконечности в вакууме вглубь проводящей фазы (например, фазы 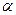 ), затраченная работа состоит из двух частей: электростатической равной
), затраченная работа состоит из двух частей: электростатической равной 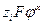 и химической, обусловленной взаимодействием реальных частиц с данной фазой, то есть химическим потенциалом
и химической, обусловленной взаимодействием реальных частиц с данной фазой, то есть химическим потенциалом 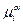 компонента
компонента 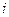 в фазе
в фазе 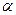 .
.
Фундаментальное уравнение Гиббса тогда запишется:
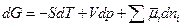 . (3.4)
. (3.4)
Рассмотрим равновесие на границе раздела фаз. Предположим, что на границе раздела фаз протекает электрохимическая реакция (электродная реакция)
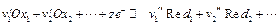 (1)
(1)
где 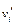 и
и 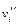 — стехиометрический коэффициент i-го вещества или иона (для исходных веществ стехиометрические коэффициенты принимают отрицательные значения, а для продуктов реакции — положительные), z — общее число электронов участвующих в электродной реакции (полуреакции).
— стехиометрический коэффициент i-го вещества или иона (для исходных веществ стехиометрические коэффициенты принимают отрицательные значения, а для продуктов реакции — положительные), z — общее число электронов участвующих в электродной реакции (полуреакции).
При протекании химической реакции количества отдельных реагентов изменяются пропорционально их стехиометрическим коэффициентам в уравнении реакции. Взаимную пропорциональность величин dni можно выразить совокупностью уравнений:
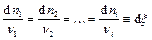
Таким образом, перераспределение количеств всех веществ в системе можно выразить с помощью единственной переменной, которая обозначается x и называется химической переменной. Дифференциал химической переменной определяется с помощью любого из приведенных выше уравнений:
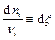 ;
;
dni = nI dx;
Тогда с учетом этого выражения для dG получим
dG = – SdT + Vdp + 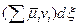 . (3.5)
. (3.5)
При постоянной температуре и постоянном давлении условием равновесия в системе является минимум энергии Гиббса. Это означает, что для равновесной системы
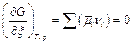 ;
;
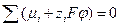 . (3.6)
. (3.6)
В этом уравнении суммируются электрохимические потенциалы и стехиометрические коэффициенты всех участников электрохимической реакции, независимо от того, в какой фазе они находятся.
Равновесие на электроде характеризуется равенством электрохимических потенциалов компонентов во всех фазах. В случае их неравенства происходит переход заряженных частиц через границу раздела фаз, что вызывается стремлением системы к термодинамическому равновесию. В результате этого нарушается баланс электрических зарядов в каждой фазе, металл и раствор приобретают электрический заряд и на границе их раздела возникает скачок потенциала. Другими словами между фазами электрода возникает определенная разность потенциалов, обусловленная природой составляющих электрод компонентов, их концентрациями и значениями внешних термодинамических параметров.
Этот скачек потенциала называется гальвани-потенциалом (потенциалом электрода) и обозначается 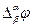 . Гальвани-потенциал определяется разностью внутренних потенциалов обеих фаз:
. Гальвани-потенциал определяется разностью внутренних потенциалов обеих фаз: 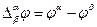 .
.
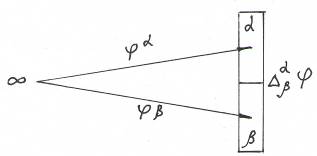
Рис. Возникновение скачка потенциала (гальвани-потенциала 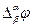 ) на границе раздела фазы
) на границе раздела фазы 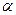 и фазы
и фазы 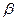 .
.
Рассмотрим механизм возникновения скачка потенциала на примере наиболее часто встречающихся электродов с границей раздела фаз металл – раствор. Существуют такие металлы, что если их опустить в воду или в раствор, то ионы металла переходят в прилегающий к поверхности металла слой воды или раствора по реакции 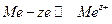 .
.
Этот переход происходит в том случае, если электрохимический потенциал иона металла в кристалле больше чем электрохимический потенциал сольватированного иона в растворе. Металл можно представить состоящим из положительно заряженных ионов металла и относительно свободных электронов. По мере перехода ионов в раствор, состояние системы постепенно изменяется. Металл приобретает отрицательный заряд, величина которого увеличивается по мере протекания электрохимической реакции. В связи с этим электрохимический потенциал ионов металла на поверхности уменьшается. Количество ионов в растворе возрастает, и их электрохимический потенциал увеличивается вследствие отталкивания одноименных ионов. В результате этого скорость перехода ионов в раствор уменьшается, а скорость обратного процесса – перехода ионов из раствора на металл возрастает. Наконец наступает такое состояние, при котором скорости обоих процессов становятся одинаковыми, то есть в системе наступает равновесие. При этом металл приобретает отрицательный заряд, которому соответствует определенный потенциал, а в растворе образуется избыток катионов, которые удерживаются у поверхности металлического электрода в результате действия электростатических сил и этому слою соответствует свой потенциал. Эти потенциалы называются внутренними потенциалами и обозначаются 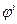 , где индекс указывает, к какой фазе относится потенциал. В результате, на границе раздела фаз металл – раствор образуется, так называемый двойной электрический слой, которому соответствует определенная разность потенциалов, называемая гальвани-потенциалом -
, где индекс указывает, к какой фазе относится потенциал. В результате, на границе раздела фаз металл – раствор образуется, так называемый двойной электрический слой, которому соответствует определенная разность потенциалов, называемая гальвани-потенциалом - 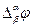
( например, 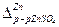 ).
).
Для определения величины гальвани-потенциала, возникающего на границе раздела фаз 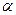 и
и 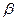 необходимо экспериментально определить разность электрохимических потенциалов в этих фазах. Так как
необходимо экспериментально определить разность электрохимических потенциалов в этих фазах. Так как 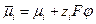 , то
, то
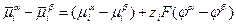 . (3.7)
. (3.7)
Из уравнения следует, что измерение гальвани-потенциала между точками в разных фазах возможно лишь при условии равенства химических потенциалов веществ в разных фазах, то есть при 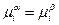 . В этом случае, получим:
. В этом случае, получим:
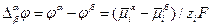 . (3.8)
. (3.8)
Отсюда следует, что на границе раздела двух фаз различного состава экспериментально определить гальвани-потенциал невозможно.
Величина гальвани-потенциала зависит от свойств фаз, образующих границу раздела и от концентрации ионов в растворе.
В общем случае, для электрохимической реакции
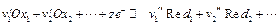 ,
,
протекающей на границе раздела фаз, условие равновесия, в соответствие с (3.6) запишется:
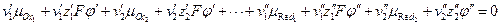 ,
,
где 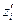 и
и 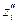 - заряды частиц окисленной и восстановленной форм,
- заряды частиц окисленной и восстановленной форм, 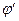 и
и 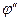 - потенциалы фаз, содержащих окисленную и восстановленную формы вещества. После преобразования уравнения получим:
- потенциалы фаз, содержащих окисленную и восстановленную формы вещества. После преобразования уравнения получим:
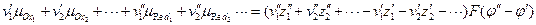 .
.
В соответствии с балансом зарядов 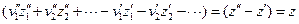 ,
,
где 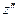 - суммарный заряд ионов, участвующих в реакции в фазе, содержащей восстановленную форму вещества, а
- суммарный заряд ионов, участвующих в реакции в фазе, содержащей восстановленную форму вещества, а 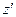 - суммарный заряд ионов, участвующих в реакции в фазе, содержащей окисленную форму вещества. Для произвольных жидких и твердых растворов химический потенциал i-го компонента выражается через его активность уравнением
- суммарный заряд ионов, участвующих в реакции в фазе, содержащей окисленную форму вещества. Для произвольных жидких и твердых растворов химический потенциал i-го компонента выражается через его активность уравнением 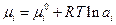 . Учитывая, что
. Учитывая, что 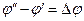 - гальвани-потенциал, получаем:
- гальвани-потенциал, получаем:
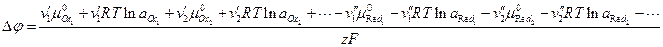
Так как стандартный химический потенциал компонента равен значению его стандартной энергии Гиббса, получим
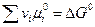 .
.
Тогда,
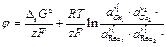 .
.
Объединив все постоянные величины в одну величину — j°, которая называется стандартным электродным потенциалом, получим выражение для разности потенциалов между фазами, составляющими электрод:
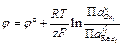 . (3.9)
. (3.9)
где j° - стандартный электродный потенциал; R – универсальная газовая постоянная;
T –температура, К; F – постоянная Фарадея; 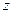 - число электронов, участвующих в электродном процессе;
- число электронов, участвующих в электродном процессе; 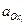 и
и 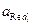 - активность окисленной и восстановленной форм.
- активность окисленной и восстановленной форм.
Полученное уравнение называется уравнением Нернста. Стандартный электродный потенциал j° — это величина, характерная для каждого электродного процесса, которая также зависит от температуры и природы растворителя. Стандартный электродный потенциал равен потенциалу электрода в котором отношение активностей всех участников электродной реакции равны единице. Уравнение Нернста связывает величину разности потенциалов между фазой раствора электролита и фазой проводника первого рода с активностями компонентов, участвующих в электродной реакции.
В качестве примера установления электрохимического равновесия рассмотрим наиболее простой случай – равновесие на границе металла с раствором, содержащим ионы этого металла. На электроде будет протекать следующая электрохимическая реакция:
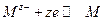 .
.
Равновесие устанавливается в результате перехода ионов металла из объема раствора на металл и обратно при условии выполнения равенства (3.6) .
Тогда условие равновесия для данной системы запишется:
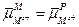 , или
, или 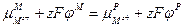 . (3.10)
. (3.10)
Из уравнения следует, что равновесный гальвани-потенциал на границе металл–раствор равен:
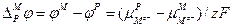 . (3.11)
. (3.11)
Для нейтральных атомов металла электрохимический потенциал равен химическому потенциалу - 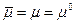 , а химический потенциал ионов выражается через активность ионов в растворе (ai) уравнением
, а химический потенциал ионов выражается через активность ионов в растворе (ai) уравнением
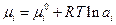 , (3.12)
, (3.12)
где 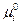 - стандартный химический потенциал i –го реагента, R — универсальная газовая постоянная, равная 8,314 Дж/(моль К), T — температура, К.
- стандартный химический потенциал i –го реагента, R — универсальная газовая постоянная, равная 8,314 Дж/(моль К), T — температура, К.
С учетом вышесказанного уравнение (3.11) будет иметь следующий вид:
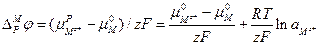 . (3.13)
. (3.13)
Объединив все постоянные величины в одну величину — j°, которая называется стандартным электродным потенциалом, получим выражение для разности потенциалов между фазами, составляющими электрод:
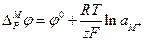 . (3.14)
. (3.14)
Комбинация констант R, F и температуры (RT / F) часто встречается в электрохимических уравнениях; она имеет размерность напряжения. Общепринято обозначать ее как b0. Часто уравнение Нернста записывается через десятичные логарифмы. Переход к десятичным логарифмам осуществляется путем умножения b0 на ln10 = 2,3 (это произведение обозначается как b). При 298 К значения b0 и b соответственно равны:
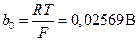 ;
; 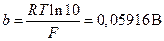 . (3.15)
. (3.15)
Значения постоянной b при других температурах могут быть легко рассчитаны.
Следует отметить, что в общем случае при записи уравнения Нернста под логарифмом остаются только те величины, которые могут варьироваться. Таким образом, при записи уравнения Нернста для разных случаев необходимо соблюдать несколько правил, связанных с применением выражения (3.9) для различных типов электродов:
1. Активности чистых компонентов, образующих отдельную фазу постоянного состава, (как правило, это твердые вещества) принимаются равными единице.
2. Активность растворителя принимается равной единице.
3. Вместо активностей газообразных веществ в уравнение входят относительные парциальные давления этих газов над раствором 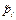 . Давление приводится относительно стандартного (1 бар = 105 Па), т. о. эта величина является безразмерной, хотя численно она совпадает с парциальным давлением газа, выраженным в барах.
. Давление приводится относительно стандартного (1 бар = 105 Па), т. о. эта величина является безразмерной, хотя численно она совпадает с парциальным давлением газа, выраженным в барах.
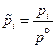 . (3.16)
. (3.16)
Использование парциальных давлений справедливо для случая не очень высоких давлений (порядка нескольких бар). В случае высоких давлений необходимо использовать фугитивности газов.
Дата добавления: 2016-01-09; просмотров: 3414;
