Примеры решения задач. Пример 1.Металлический предмет поверхностью 100 см2 требуется покрыть никелем слоем в 0,3 мм
Пример 1.Металлический предмет поверхностью 100 см2 требуется покрыть никелем слоем в 0,3 мм. Плотность никеля 9,0 г/см3. Сколько времени требуется пропускать ток силой 3 А, если 10% тока теряется в аппарате?
Решение.
1. Определим массу никеля, необходимую для покрытия:

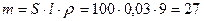 г.
г.
2. По закону Фарадея найдем необходимое количество электричества:
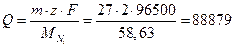 Кл.
Кл.
3. При силе тока в 3 А потребуется время электролиза:
 .
.
4. Учтем 10% возможных потерь:
t¢ = 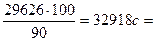 9 ч 8 мин.
9 ч 8 мин.
Пример 2. Раствор, содержащий 1,139·10–3 г ионов серебра в 1 см3, подвергался электролизу между серебряными электродами. После электролиза методом титрования пробы было установлено, что 20,09 см3 анодной жидкости содержит 0,03966 г ионов серебра. За время электролиза в присоединенном последовательно кулонометре отложилось 0,0321 г серебра. Найдите числа переноса ионов Ag+ и NO3–. Изменится ли концентрация раствора в среднем пространстве?
Решение. Составим материальный баланс изменения концентрации для анодного пространства при прохождении через раствор 96 500 Кл (1 F) электричества:
(–) Ag| AgNO3(aq) | AgNO3(aq) | AgNO3(aq)|Ag (+)
катод катодное среднее анодное анод
пространство пространство пространство
В данном случае анод растворяется за счет электрохимической реакции
Ag →Ag+ +е–
В анодное пространство из среднего диффундируют ионы NO3– и переносят молярную массу эквивалента t– (г/моль). В среднее пространство диффундируют из анодного пространства ионы серебра и уносят молярную массу эквивалента t+ (г/моль).
Материальный баланс для анодного пространства раствора
+l Ag+ – t+Ag+ + t–NO3 = + t– AgNO3.
Из уравнения следует, что при пропускании одного Фарадея электричества, содержание азотнокислого серебра в анодном пространстве увеличится на t- молей.
Изменение молярной массы эквивалентов ионов серебра в анодном пространстве составит
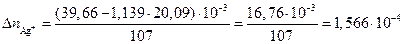 моль.
моль.
Общее количество электричества пропущенного через раствор пропорционально количеству серебра, выделенного в серебряном кулонометре за время электролиза
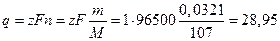 кулонов
кулонов
Тогда можно составить пропорцию, из которой можно определить число переноса аниона.
При пропускании одного Фарадея (96500 к) электричества, содержание азотнокислого серебра в анодном пространстве увеличится на t- молей, а при пропускании q = 28,95 к электричества, содержание азотнокислого серебра в анодном пространстве увеличилось на 1,566 10-4 молей. Отсюда:
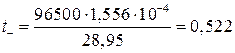
Число переноса катиона Ag+ находим по разности
t+ = 1 – t– = 1 – 0,522 = 0,478.
Материальный баланс для среднего пространства показывает, что концентрация раствора в среднем пространстве за время электролиза не изменится:
– t+ Ag+ + t– NO3– + t+ Ag+ – t– NO3– = 0.
Пример 3. После электролиза раствора CdCl2 (с массовой долей хлорид-ионов 0,2020%) с растворимым кадмиевым анодом и платиновым катодом, 33,59 г раствора анодного пространства содержало ионы хлора, масса которых равна 0,0802 г. В серебряном кулонометре за это время выделилось серебро массой 0,0666 г. Найдите числа переноса Сd2+ и Cl–.
Решение. Рассчитаем, чему равно изменение массы хлорид-ионов для анодного пространства при пропускании 1 F электричества.
(–)Pt |CdCl2(aq) | CdCl2(aq) | CdCl2(aq) |Cd (+)
катод катодное среднее анодное анод
пространство пространство пространство
Электрохимическая реакция на аноде
Cd → Cd 2+ + 2е–
Молярная масса эквивалента ионов в анодном пространстве изменится за счет:
растворения анода на +1(½Сd2+)
ухода в среднее пространство
катионов на – t+(½ Сd2+)
прихода из среднего пространства
анионов на + t– ( Cl-)
Материальный баланс для анодного пространства раствора
+1(½ Сd2+) – t+(½ Сd2+) + t– ( Сl-) = + t– (½ СdCl2) г/моль.
Масса хлорид-ионов до электролиза в 33,59 г анодной жидкости равна
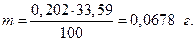
Изменение молярной массы хлорид-ионов в анодном пространстве составит
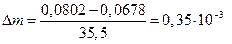 г.
г.
Число пропущенных фарадеев электричества равно
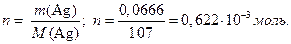
Число переноса хлорид-ионов находим по соотношению:
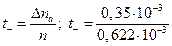 = 0,563.
= 0,563.
Число переноса катиона Cd2+ находим по разности
t+ = 1 – t– = 1 – 0,563 = 0,437.
Вопросы для самоконтроля
1. Сколько и каких продуктов можно получить в результате пропускания тока силой 10 А через электролизер в течение часа, если электролизер заполнен:
а) расплавом иодида серебра;
б) разбавленным водным раствором иодида серебра.
2.Для калибровки шкалы амперметра, имеющей100 делений, использовали газовый кулонометр, включенный последовательно с амперметром. Силу тока в цепи установили равной 50 делениям амперметра. За 100 с электролиза в кулонометре выделилось 9,47 см3 смеси газов (объем замерен при температуре 20°С и давлении 9,87.105 Па). Чему равна цена деления амперметра?
3. Число переноса для иона цинка в растворе ZnCl2 равно 0,4. Через раствор хлористого цинка пропускается ток 0,167 А в течение 50 минут. Электроды платиновые. Найдите убыль концентрации ZnCl2 в граммах в катодном и анодном слоях раствора.
4. Составьте схему процессов, протекающих на катоде и на аноде при электролизе раствора CuSO4, если оба электрода: а) платиновые; б) медные.
5. Ток, силой 0,2 А пропускается 300 с через раствор H2SO4 . Каков объем выделившихся Н2 и О2 при 300 К и давлении 1,013.105 Па, если выход по току составляет 80 %?
6. По какому уравнению и как можно рассчитать 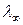 ? Рассчитайте
? Рассчитайте 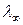 для электролита Na2SO4.
для электролита Na2SO4.
Дата добавления: 2016-01-09; просмотров: 4020;
