Молярная электрическая проводимость растворов электролитов
Молярная электрическая проводимостьраствора l - мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации. Она численно равна электрической проводимости такого объёма V (м3) раствора, который заключен между двумя параллельными электродами, с межэлектродным расстоянием 1м, причём каждый электрод имеет такую площадь, чтобы в этом объёме содержался 1 моль растворённого вещества. Между молярной и удельной электрическими проводимостями имеется соотношение
l = æV = æс, (2.4)
где l – молярная электрическая проводимость, См×м2моль; æ – удельная электрическая проводимость; См м; V – разведение раствора, м3 моль; с – концентрация раствора электролита, моль м3.
Если концентрация раствора выражена в мольл, т.е. моль/дм3, то уравнение (2.4) записывается в виде:
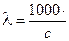 æ . (2.5)
æ . (2.5)
Молярная электрическая проводимость прямо пропорциональна абсолютным скоростям движения ионов (u+ , u- ):
l = a·F(u++u-). (2.6)
Абсолютной скоростью движения иона называется его скорость при градиенте потенциала в 1 В/·м, её размерность [ иi ] = В·м2·с-1.
Общий характер изменений молярной электрической проводимости с концентрацией для сильных и слабых электролитов выражен кривыми, представленными на рис.2.
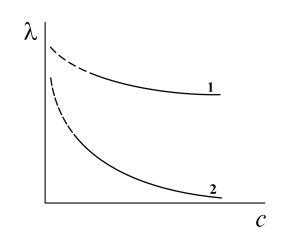 Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации.
Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации.
|
С увеличением разведения, т.е. с уменьшением концентрации раствора, молярная электрическая проводимость возрастает и в области разведений стремится к предельному значению l¥ .
Эта величина отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита (a=1) и отсутствием сил электростатического взаимодействия между ионами.
В соответствии с (2.6) молярная электрическая проводимость бесконечно разбавленного раствора будет выражаться уравнением:
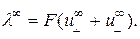 (2.7)
(2.7)
Произведение 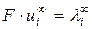 называетсяпредельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде:
называетсяпредельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде:
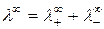 . (2.8)
. (2.8)
Предельная молярная электрическая проводимость является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры.
Величина молярной электрической проводимости бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определённому виду ионов, т.е. сумму подвижностей ионов при предельном разбавлении. Это соотношение установлено Кольраушем и называется законом независимого движения ионов. Величина молярной электрической проводимости определяется по подвижностям ионов, которые приведены в справочнике.
Подвижности большинства ионов примерно одинаковы, кроме ионов H3O+ и OH-, которые обладают очень высокими абсолютными скоростями. Причиной этого явления является эстафетный механизм перемещения этих ионов в растворе от одной молекулы растворителя к другой.
Кондуктометрия
Кондуктометрия основана на измерении электрической проводимости растворов электролитов. В электрохимической промышленности электрохимическая проводимость играет большую роль при составлении энергетических и тепловых балансов электролизеров и химических источников тока, а так же в мембранной технологии.
Экспериментальной величиной в методе кондуктометрии является сопротивление раствора электролита. Для измерения сопротивления применяется мостовая схема Уинстона. Принцип измерения электрической проводимости растворов электролитов приведен на рис.3.
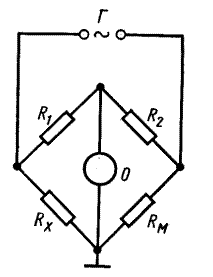 Рис. 3 Схема установки для измерения электрического сопротивления раствора электролита.
RМ и Rx – сопротивления магазина и ячейки; Г - источник переменного тока; О – осциллограф.
Рис. 3 Схема установки для измерения электрического сопротивления раствора электролита.
RМ и Rx – сопротивления магазина и ячейки; Г - источник переменного тока; О – осциллограф.
|
В основе этой схемы лежит метод компенсации. Во избежание электролиза, влекущего за собой изменение концентрации электролита и поляризацию электродов, при компенсационном способе измерения сопротивления используется переменный ток высокой частоты. Форма и расположение электродов во всех измерениях должны быть постоянным. По экспериментально определенному сопротивлению исследуемого раствора рассчитывают значения удельной и молярной электрической проводимости электролитов.
Метод кондуктометрии используется для определения ряда физико-химических характеристик растворов электролитов.
1. Степень диссоциации слабых электролитов рассчитывается по уравнению
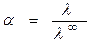 , (2.9)
, (2.9)
где 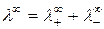 определяется по значениям предельной молярной электрической проводимости ионов
определяется по значениям предельной молярной электрической проводимости ионов
2. Константу диссоциации бинарного электролита можно рассчитать по уравнению (1.3):
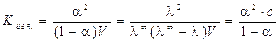 . (2.10)
. (2.10)
3. По данным кондуктометрии можно рассчитать pH раствора, образованного растворением электролита, при диссоциации которого образуются ионы водорода. Так, для бинарного электролита
pH = -lg aС. (2.11)
4. По данным кондуктометрии можно рассчитать растворимость (С) и произведение растворимости (Lр) малорастворимой соли:
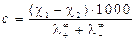 и
и 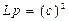 . (2.12)
. (2.12)
Дата добавления: 2016-01-09; просмотров: 2077;
