Биологическая роль K и Na. Взаимосвязь ионов K и Na в биологических системах. Калий как необходимый элемент цитоплазмы, натрий как элемент межклеточных растворов
Содержание натрия в организме человека массой 70 кг составляет 60г. Из этого 44% натрия находится во внеклеточной жидкости и 9% - во внутриклеточной. Концентрация Na+ внутри клетки приблизительно в 15 раз меньше, чем во внеклеточной жидкости. Наоборот, концентрация К+ приблизительно в 35 раз выше внутри клетки, чем вне ее.
Остальное количество находится в костной ткани, являющейся местом депонирования иона Na+ в организме (около 40%). Натрий – основной внеклеточный ион, в организме находится в виде растворимых солее NaCl, Na3PO4, NaHCO3, распределен в сыворотке крови, спинномозговой жидкости, по всему организму, глазной жидкости, пищеварительных соках, желчи, почках, легких, мозге. Натрий поддерживает постоянство осмотического давления и кислотно-основное равновесие (фосфатная буферная система Na2HPO4 + NaH2PO4).
Натрий содержится в поваренной соли, овощах. Натрий концентрируют в больших количествах водоросли, ламинарии, фукусы. Высокие содержания натрия способна переносить сахарная свекла.
. В поддержании кислотно - щелочного равновесия в организме важнейшая роль принадлежит натрию. Его главная обязанность поддерживать нормальное кровяное давление, защищать организм от потери жидкости, влиять на мышечную активность.
Радиоактивный 24Na используется в качестве метки для определения скорости кровотока и для лечения некоторых форм лейкимии.
NaCl – основной источник соляной кислоты для желудочного сока. Непрерывное, избыточное появление NaCl в организме способствует развитию гипертонии. Около 90% потребляемого натрия выводится мочой, а остальные – с потом и калом.
Изотонический раствор NaCl (0,9%) для инъекций вводят подкожно, внутривенно при обезвоживании организма и при интоксикациях, а также применяют для промывания глаз, слизистой оболочки носа, а также для растворения лекарственных препаратов.
Гипертонические растворы NaCl (3-5-10%) применяют наружно в виде компрессов и примочек при лечении гнойных ран. Применение таких компрессов способствует, по законам осмоса, отделению гноя из ран и плазмолизу бактерий.
NaCl – используется для консервирования продукции сельского хозяйства (соления, квашения овощей).
NaOH – (каустическая сода) используется в мыловаренной, кожевенной, фармацевтической, текстильной промышленность и в сельском хозяйстве, 10%-ый раствор входит в состав силамина, применяемого в ортопедической практике для отливки огнеупорных моделей.
NaHCO3 (питьевая, чайная сода) – применяют в виде полосканий, промываний при воспалительных заболеваниях глаз, слизистых оболочек верхних дыхательных путей. Действие основано на гидролизе, раствор имеет слабощелочную среду.
NaHCO3 + H2O ↔ NaOH + H2CO3.
При воздействии щелочей на микробные клетки происходит осаждение клеточных белков и вследствие этого гибель микроорганизмов. NaHCO3 применяется в кондитерском деле, в медицине, в лабораторной практике.
NaHCO3 – используют при повышенной кислотности (ацидоз), взаимодействует с кислыми продуктами, образуя натриевые соли органических кислот, которые выводятся с мочой, а СО2 с выдыхаемым воздухом.
NaHCO3 + HCl = NaCl + H2O + CO2
– нейтрализуется избыточная соляная кислота. Слишком большая доза NaHCO3 приводит к алкалозу, что не менее вредно, чем ацидоз.
Na2CO3 – (кальцинированная сода).
Na2CO3 • 10H2O – (кристаллическая сода), потребляется мыловаренной, стекольной, текстильной, бумажной, нефтяной промышленностью.
Na2SO4 • 10H2O – глауберова соль (мирабилит) или слабительное. Эта соль медленно всасывается из кишечника, что приводит к повышению осмотического давления и накоплению воды в кишечнике, содержимое его разжижается, и каловые массы быстрее выводятся из организма.
Na2B4O7 · 10H2O -(бура) применяется наружно, как антисептическое средство для полосканий, спринцеваний, смазываний. Антисептическое действие аналогично NaHCO3 и связано с гидролизом и с образованием противомикробного лекарственного средства борной кислоты.
Na2B4O7 + 7H2O ↔ 4H3BO3 + 2NaOH
NaNO3 – натриевая (чилийская) селитра, азотное удобрение с нитратной формой азота.
Na3[AlF6] – криолит
Наибольшее практическое значение среди соединений натрия имеют: NaOH – каустическая сода, NaHCO3 – питьевая сода, Na2CO3 - кальцинированная сода, Na2CO3×10H2O – кристаллическая сода.
Калий.
Содержание калия в организме 70 кг приблизительно 160г. Калий - основной внутриклеточный катион, распространен по всему организму: печень, почки, сердце, костная ткань, мышцы, кровь, мозг. Ионы К+ играют важную роль в физиологических процессах – сокращении мышц, функционировании сердца, проведении нервных импульсов. Калий антагонист натрия. Калий в отличие от натрия «работает» внутри клеток, где участвует в регулировании водного баланса. Необходим калий для нормальной работы сердечной мышцы.
Почти все соли калия хорошо растворимы в воде, но в отличие от солей натрия не содержат кристаллизационной воды. Вместе с азотом и фосфором, калий – один из основных элементов питания растений, при отсутствии его они погибают.
Забирают из почвы калий подсолнечник, лен, конопля и калий накапливается в их стеблях. Калий участвует в процессе фотосинтеза, приводит к снижению содержания сахаров в корнеплодах свеклы и крахмала в зерне, отмиранию листьев растений, снижению всхожести семян, восприимчивости к грибковым заболеваниям.
Na и К присутствуют в почвах в трех основных формах – необменной, обменной, водорастворимой. Основная масса щелочных металлов (более 99 %) в необменной форме. В обменной форме калия больше чем натрия, т.к. калий прочнее удерживается почвенными ионообменниками. Натрий входит в ППК только в солонцах и засоленных почвах. В почвенных растворах натрий преобладает над калием. Катионы Na+ слабо удерживаются почвенными массами, мигрируют на далекие расстояния. Накапливаются в океанах, морях, соленых озерах.
Соли натрия накапливаются в почвах засушливых районов, вызывая засоление. Засоленные почвы (солонцы, солончаки, солоди) содержат много Na2CO3, Na2SO4, NaCl. Для этих почв характерны щелочная среда, высокое осмотическое давление, так называемая физиологическая сухость. Это нарушает поступление воды в корни растений, вызывает их увядание и гибель. Эти почвы подвергают нейтрализации и рассолонцеванию. Для этого вносят гипс CaSO4•2H2O (гипсование).
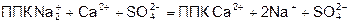
Особенно велика биогенная роль калия. В культурных растениях большие содержания калия обнаружены в картофеле, свекле, табаке, изюме, черносливе, цветной капусте, редьке, абрикосах, подсолнечнике. В животных организмах калий имеется в печени, селезенке. Велико содержания калия в эритроцитах, крови животных. В организмах калий находится в виде минеральных солей органических кислот (щавелевой, лимонной, пировиноградной). Установлено, что соли калия не могут быть заменены в организме никакими другими солями.
При недостатке калия в почвах растения поражаются грибковыми и бактериальными болезнями, листья их бледнеют и отмирают.
При нарушении деятельности почек у животных калий накапливается в крови, что приводит к тяжелым расстройствам функций сердца, мышц, центральной нервной системы. Калий играет большую роль в обмене веществ и фотосинтезе. Ферсман сказал о значении калия для организмов «Калий – основа жизни растений».
KCl – концентрированное калийное удобрение, является сырьем для получения сильвинита (KCl ×NaCl).
KNO3– калийная селитра, сложное удобрение, содержит два элемента питания растений – калий и азот, используется в производстве тугоплавкого стекла и черного пороха.
KPO3 – метафосфат, сложное удобрение содержит – два элемента калий и фосфор.
K2SO4– самое дорогое из калийных удобрений, т.к. методы получения дороги.
K2CO3 (поташ) – зола, необходим в мыловарении, стекольном производстве, в фотографии, при крашении тканей.
K2O×Al2O3×6H2O– полевой шпат (ортоклаз).
ЛЕКЦИЯ 2
Тема: s - ЭЛЕМЕНТЫ II ГРУППЫ
Дата добавления: 2016-01-30; просмотров: 6704;
