Получение соды по методу Сольве
Исходные вещества NH3, CO2, NaCl,
вначале получают CO2
CaCO3 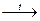 CaO + CO2
CaO + CO2
В теплый насыщенный раствор NaCl пропускают аммиак, а затем углекислый газ, вначале образуется NH4HCO3
1) 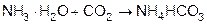 ,
,
далее он вступает в обменную реакцию с NaCl
2) 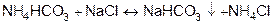 .
.
Из 4-х солей наименее растворим в воде NaHCO3, который выпадает в осадок, затем при нагревании
3) 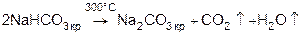 .
.
2. Водород (Hydrogenium – воду рождающий)
Имеет 3 изотопа: протий 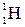 , дейтерий
, дейтерий 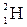 или Д и тритий
или Д и тритий 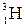 или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
или Т, тритий образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучения.
Свободного водорода на Земле почти нет, в атмосфере его содержание не превышает 5×10-5%. Практически весь водород находится в связанном состоянии в составе многих минералов, углей, нефти, живых и растительных организмов, но самым распространенным его соединением является вода.
Водород – s-элемент, в различных вариантах периодической системы помещают его то в I A, вместе со щелочными металлами, то в VII A вместе с галогенами, а иногда рассматривают отдельно.
Со щелочными металлами он сходен в том, что образует положительный ион Н+ и играет роль восстановителя.
Но с галогенами у него больше сходства: в гидридах активных металлов (CaH2, NaH), содержится ион Н-, подобный ионам Г- (NaCl, CaCl2). Молекулы водорода и галогенов двухатомны (Н2, Cl2, Br2). Для водорода, как и для фтора, хлора, характерны газообразное состояние и неметаллические свойства. Потенциалы ионизации водорода и галогенов близки. Атомы водорода легко замещаются атомами галогенов в органических соединениях. Поэтому вариант ПС, где Н возглавляет VII А группу более правилен.
Особенности водорода – единственный валентный электрон водорода находится непосредственно в зоне действия атомного ядра. Особенностями строения атома водорода обусловлено существование водородной связи.
Получение Н2
В промышленности водород получают из воды и углеводородов. При этом восстановителем водорода при температуре (600-900°С) являются атомы углерода
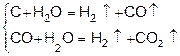 .
.
Конверсия метана с водяным паром:
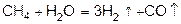 .
.
При более высокой температуре (950-1100°) можно получить разложением метана особо чистый водород и углерод.
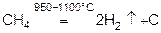
В лаборатории:
1) при действии разбавленного раствора кислоты на активный металл (в аппарате Киппа):
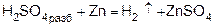
или
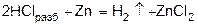
2) щелочные металлы и щелочноземельные вытесняют водород из воды.
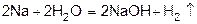
3) действием едких щелочей на металлы
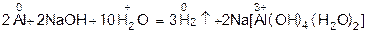
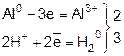
или 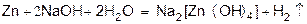
4) разложением гидридов типичных металлов водой
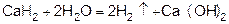
5) электролизом воды (электролиз водных растворов щелочей).
2H2O 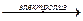 2H2 + O2
2H2 + O2
Физические свойства. В обычных условиях водород – это самый легкий газ без цвета, запаха и вкуса, плохо растворим в воде.
Атомарный водород гораздо активнее молекулярного, для которого нужны дополнительные затраты энергии на расcпаривание электронов.
По электроотрицательности занимает промежуточное положение между неметаллами и металлами. И в реакциях с неметаллами и кислородсодержащими веществами играет роль восстановителя.
Химические свойства Н2
Водород легко соединяется с кислородом, горит на воздухе или в атмосфере чистого кислорода бледно-синим пламенем.
1) 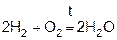
Если состав смеси приближается к стехиометрическому
(2 объема Н2 и 1 объем кислорода), то смесь называется “гремучим газом”, т.к. реакция имеет в этом случае взрывной характер.
Водородно-кислородное пламя, имеющее температуру 2500°-2800°С используют для плавления тугоплавких металлов и автогенной сварки.
2) 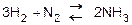 (при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
(при температуре 450 – 5000С и повышенном давлении, в присутствии катализатора).
3) 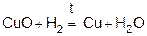 (при нагревании).
(при нагревании).
4) 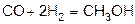 (при повышении температуры и давления, в присутствии катализатора).
(при повышении температуры и давления, в присутствии катализатора).
5) 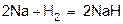 (с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н- (гидрид-ион).
(с очень активными металлами водород взаимодействует непосредственно как окислитель, превращаясь в ион Н- (гидрид-ион).
3. Вода и ее свойства. Экологическое и биологическое значение Н2О
Три изотопа водорода 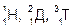 и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
и три стабильных изотопа кислорода 16О, 17О, 18О в различных сочетаниях могут образовывать 18 изотопических разновидностей воды с молекулярными массами от 18 до 24 (Т218О). В тяжелой воде вещества растворяются хуже, растворы меньше проводят электрический ток. Она гигроскопична, жадно поглощает влагу из воздуха. Помещенные в нее без предварительной подготовки живые существа (рыбы, черви и т.п.) погибают, семена в ней не прорастают, микробы не живут. Вода имеет очень большое значение в жизни растений, животных и человека. Согласно с современными представлениями происхождение жизни связано с водной средой. Во всяком живом организме в воде протекают химические процессы, обеспечивающие жизнедеятельность организма.
|
Вода обладает аномально большой теплоемкостью равной 4,18 , песок = 0,79, NaCl = 0,88 (Дж/(г×К).
Поэтому это имеет большое значение для жизни. При переходе от лета к зиме, ото дня к ночи она остывает медленно и является регулятором температуры на земном шаре.
Она имеет самую высокую температуру кипения в ряду
Н2О – Н2S – H2Se – H2Te,
Tкипения, °С 100 -60 -41 -2
Если от H2Te к Н2S температура кипения закономерно уменьшается, то при переходе от Н2S к Н2О резко увеличивается. Это объясняется наличием водородной связи между молекулами воды, вследствие кулоновского взаимодействия положительно заряженного атома водорода одной молекулы и электроотрицательным атомом кислорода другой
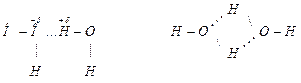
Такое взаимодействие затрудняет отрыв молекул друг от друга, т.е. уменьшает их летучесть, а, следовательно, повышает температуру кипения.
Молекула воды из-за sp3-гибридизации орбиталей атома кислорода имеет угловую конфигурацию, а атомы водорода, соединенные с сильно-электроотрицательным атомом кислорода, определяют ее способность к установлению четырех водородных связей с соседними молекулами.
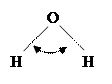
|
Химические свойства Н2О
Вода – очень активный реагент по следующим причинам:
а) за счет ориентационного взаимодействия с полярными молекулами других веществ;
б) установления водородных связей;
в) проявления донорных свойств со стороны атома кислорода по отношению к частицам – акцепторам электронных пар;
г) электролитической диссоциации при обычных условиях (ионы Н+ гидратируются, образуя ионы Н3О+ ).
1. При температуре выше 1000°С диссоциация водяного пара, но равновесие сдвинуто в сторону воды.
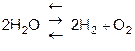 .
.
2. Оксиды металлов и неметаллов соединяются с водой, образуя основания и кислоты (гидрооксиды).
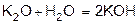
3. Некоторые соли образуют с водой кристаллогидраты. При растворении веществ с ионной структурой молекулы растворителя удерживаются около иона силами электростатического притяжения, т.е. за счет ион -дипольного взаимодействия.
Например: кристаллогидрат сульфата натрия Na2SO4×10H2O (глауберова соль), Na2CO3×10H2O - кристаллическая сода.
Гидраты, образующиеся в результате донорно-акцепторного взаимодействия (где ионы растворенного вещества выступают обычно в качестве акцепторов, а молекулы растворителя в качестве доноров электронных пар) представляют собой частный случай комплексных соединений.
Аквакомплексы– лигaндами является вода, [Co(H2O)6]Cl2, [Al(H2O)6]Cl3, [Cr(H2O)6]Cl3 и др. Некоторые аквакомлексы в кристаллическом состоянии удерживают кристаллизационную воду [Cu(H2O)4]SO4×H2O – медный купорос.
4. Пероксид водорода. Окислительно - восстановительная двойственность Н2О2
1. Строение молекулы. Структурная формула Н - О – О - Н. Энергия связи О-О (210 кДж/моль) почти в 2 раза меньше энергии связи О-Н (468 кДж/моль). Из-за несимметричного распределения связей Н - О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150°С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение (σ) больше, чем у Н2О.
В молекуле Н2О2 связи между атомами кислорода и водорода полярны (вследствие смещения общих электронных пар к кислороду). В водных растворах – это слабая кислота, хоть и в незначительной степени распадается на ионы:
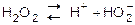 I ст. К1 = 2,6×10-12.
I ст. К1 = 2,6×10-12.
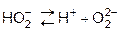 II ст. практически не протекает,
II ст. практически не протекает,
т.к. подавляется диссоциацией Н2О, которая протекает в большей степени, чем Н2О2. Сместить диссоциацию по 2-й ступени можно введением щелочи.
2. С некоторыми основаниями Н2О2 взаимодействует непосредственно образуя соли, что подтверждает его кислотные свойства.
Ba(OH)2 + H2O2 = BaO2 + 2H2O
соль
пероксида водорода
3. В отличие от воды пероксид водорода – непрочное соединение, разлагается даже при комнатной температуре (диспропорционирует на свету)
Н2О2-1 + Н2О2-1 = О20 + 2Н2О-2
Н2О2 = Н2О+ О
Неустойчивость Н2О2 обусловлена непрочностью связи О - О.
Атомы кислорода в молекуле Н2О2 связаны непосредственно друг с другом неполярной ковалентной связью. Связи О - Н полярны. Поэтому молекула Н2О2 также полярна.
Пероксиды относят к классу солей. Как соли они могут вступать в реакцию обмена с кислотами:
ВаО2 + Н2SO4 = BaSO4¯ + H2O2
в отличие от оксидов
SnO2 + 2H2SO4 = Sn(SO4)2 + 2H2O
Этой реакцией пользуются для различия оксидов и пероксидов.
 Н 0.95 А0 = 0,095нм
Н 0.95 А0 = 0,095нм
1,48 А0 = 0,148нм
120°
О О
95°
Н
ЕО-О = 210 кДж/моль ЕО-Н = 468 Дж/моль
Молекула нелинейна, две связи О - Н расположены не симметрично, а в 2-х плоскостях под углом 120°. Поэтому полярность mН2О2 > mН2О.
4. Окислительно-восстановительная двойственность Н2О2
Н2О2 + 2КI = I2 + 2KOH
окислитель восстановитель
Н2О2 + Ag+2O = 2Ag0 + O2 + H2O
восстановитель окислитель
H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
H2O2 + KI + H2SO4 → H2O + I2 + K2SO4
Na2O2 и K2O2 – используют для регенерации кислорода в подводных лодках и в изолирующих противогазах.
2Na2O2 + 2CO2 → 2Na2CO3 + O2↑
Наличие атомарного кислорода сообщает Н2О2 и Na2O2 сильные окислительные свойства. Na2O2 способен гидролизоваться с образованием H2O2 по реакции
Na2O2 + 2H2O = 2NaOH + H2O2
В связи с этим они находят применение для отбеливания шерсти, шелка, мехов.
Аптечная перекись водорода – 3% водный раствор Н2О2, применяется как дезинфицирующее средство, (30% раствор называется пергидроль).
Дата добавления: 2016-01-30; просмотров: 4469;
